有A、B、C、D、E四种短周期元素,原子序数依次增大,在周期表中B与C相邻、D与E相邻。已知A原子的电子层数与它的核外电子总数相同。B元素的氢化物与E元素的氢化物反应只生成一种盐;C、D位于同一族,它们能组成DC2、DC3两种常见化合物。请回答下列问题:
(1)C是________,D是____________,E是____________(填元素名称)。
(2)由A、B、C中的两种元素组成,且与A2C分子具有相同电子数的两种阳离子是________和________(写化学式)。
(3)D与E可形成共价化合物D2E2,分子中D与E均满足8电子稳定结构,则D2E2的电子式为_______。
(4)A、B、C可以形成一种盐,此盐中A、B、C元素的原子的个数比为4:2:3,该盐的化学式是____________。该盐受热可产生B的单质和B的最高价氧化物的水化物,对应化学方程式是____________。
(5)A、B可以形成一种离子化合物,电子式是____________
下表为元素周期表的一部分,表中列出10种元素在周期表中的位置,按要求回答下列问题。
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
|
|
|
④ |
⑤ |
⑥ |
⑧ |
⑩ |
| 3 |
① |
|
|
|
|
⑦ |
⑨ |
|
| 4 |
② |
③ |
|
|
|
|
|
|
(1)在这10种元素中,化学性质最不活泼的是 (写序号),失电子能力最强的原子是_____(用元素符号表示)。
(2)在这10种元素中,最高价氧化物的水化物碱性最强的是 (填化学式),最高价氧化物的水化物酸性最强的是 (填化学式)。
(3)H分别与④、⑤、⑦、⑧、⑨形成的化合物中,最稳定的是 (填化学式);
(4)①、⑧、⑨三种元素单核离子半径由小到大的顺序是(用相应的离子符号表示):
(5)写出③和⑨形成的化合物的电子式 ,化学键类型为____ (“离子键”或“共价键”)。
下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
| 族 周期 |
IA |
|
0 |
|||||
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
|
|
|
② |
③ |
④ |
|
|
| 3 |
⑤ |
|
⑥ |
⑦ |
|
|
⑧ |
|
(1)⑧的原子结构示意图为_________。
(2)②的气态氢化物分子的结构式为_______,②和⑦的气态氢化物的稳定性相比,其中较弱的是____(用该氢化物的化学式表示)。
(3)②、③的最高价含氧酸的酸性由强到弱的顺序是 (填化学式)。
(4)⑤、⑥元素的金属性强弱依次为___________(填“增大”、“减小”或“不变”)。
(5)④、⑤、⑥的形成的简单离子半径依次_________(填“增大”、“减小”或“不变”)。
(6)①、④、⑤元素可形成既含离子键又含共价键的化合物,写出它的电子式: ,形成的晶体是 晶体。
I.下列是中学化学中熟悉的物质,请用序号完成下列问题
①O2 ②Na2O2 ③NH4Cl ④HCl ⑤NaOH ⑥CaCl2
(1)这些物质中,只含共价键的是 。
(2)只含离子键的是 。
(3)既含共价键又含离子键的是 。
(4)属于离子化合物的是 ,属于共价化合物的是 。
II.(1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是 。(填“吸热”或“放热”)反应,NO2和CO的总能量 (填“大于”、“小于”或“等于”)CO2和NO的总能量。
(2)下列反应中,属于放热反应的是 ,属于吸热反应的是 。
①物质燃烧;
②酸碱中和反应;
③Ba(OH)2·8H2O与NH4Cl反应;
④二氧化碳通过炽热的碳;
⑤铝与四氧化铁在高温条件下的反应
【化学——物质结构与性质】氢、碳、氮都是重要的非金属元素,它们单质及其化合物在科学研究和工业生产中有重要的应用。
(1)下列微粒基态的电子排布中未成对电子数最多的是_______(填序号)
a.Fe
b.Mn
c.Cu
d.Cr
e.C
(2)含氮配合物W的结构如图所示(配位键未标出方向),请在结构图中用“→”标出W中所存在的所有配位键的方向。
(3)C、H元素形成的某有机化合物分子中共有16个电子,该分子中 键与
键与 键的个数比为_______;该有机化合物在一定条件下形成的聚合物中C原子采取_______杂化。
键的个数比为_______;该有机化合物在一定条件下形成的聚合物中C原子采取_______杂化。
(4)N和Cu元素形成的化合物的晶胞结构如图所示,则该化合物的化学式为_______。该化合物的相对分子质量为M,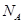 为阿伏加德罗常数。若该晶胞的边长为a pm,则该晶体的密度是_______g.pm
为阿伏加德罗常数。若该晶胞的边长为a pm,则该晶体的密度是_______g.pm 。
。
下表是元素周期表一部分,列出了九种元素在周期表中的位置:
| 族 周期 |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
| 2 |
|
|
|
⑤ |
⑥ |
⑦ |
⑧ |
|
| 3 |
① |
③ |
④ |
|
|
|
⑨ |
|
| 4 |
② |
|
|
|
|
|
|
|
请用化学用语回答下列问题
(1)在上述元素中,金属性最强的是 ,在③~⑦元素中,原子半径最大的是 ;
(2)①~⑨中元素最高价氧化物对应的水化物中酸性最强的是 (填物质化学式)。写出①和④的最高价氧化物对应的水化物反应的离子方程式 。
(3)用电子式表示③和⑨形成的化合物的形成过程 。
(4)表中元素①和⑦可以形成一种淡黄色物质X,写出X的电子式: ,该物质所含化学键类型 ,0.1mol X与水反应转移电子数为: 。
(5)表中元素⑥和⑧可形成一种相对分子量为66的共价化合物Y,Y分子中各原子均达到“8电子稳定结构”,Y的结构式 。
某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断。
(1)该微粒是中性微粒,这种微粒的元素符号是____________;
(2)该微粒的符号为X3-,则这种微粒的单质的电子式为___________;
(3)该微粒的还原性很弱,失去1个电子后变为原子,原子的氧化性很强,该单质与水反应的化学方程式___________________________________;
(4)该微粒的氧化性很弱,得到1个电子后变为原子,原子的还原性很强,该单质与水反应的离子方程式:________________________________;
(5)该微粒的还原性很弱,失去2个电子后变成原子,其氢化物的结构式:__________;
(6)该微粒的符号为X3+,其氢氧化物与强碱反应的离子方程式:______________________.
A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A原子核内无中子;B元素的最高价氧化物对应水化物与其氢化物能反应生成盐F;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的3/4,A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物。请回答下列问题:
(1)C元素在元素周期表中的位置是 ;C、D、E三种元素简单离子半径由大到小的顺序为 (用离子符号表示)。
(2)写出分别由A、D与C形成的原子个数比为1:1的化合物的电子式 、 。
(3)A与C、E间分别形成甲、乙两种共价化合物,且甲有10个电子,乙有18个电子,则沸点较高的是(填化学式) 。
(4)F含有的化学键类型是 、 。
(5)D和C形成的一种化合物能与A和C形成的一种化合物反应产生C单质,该反应的离子方程式为 。
(6)用电子式表示A、B形成化合物的过程: 。
下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0族 |
| 2 |
|
|
|
① |
② |
③ |
|
|
| 3 |
④ |
|
⑤ |
|
|
⑥ |
⑦ |
⑧ |
| 4 |
⑨ |
|
|
|
|
|
⑩ |
|
(1)在这些元素中,化学性质最不活泼的是_____(填具体元素符号,下同),原子结构示意图为_______。元素⑩名称为________在周期表中的位置________。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是________,碱性最强的化合物的电子式是________。
(3)用电子式表示元素④与⑥的化合物的形成过程:________________,该化合物属于________(填“共价”或“离子”)化合物。
(4)表示①与⑦的化合物的电子式________,该化合物是由________(填“极性”、“非极性”)键形成的。
(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是______________。
(6)④和③形成含有非极性共价键的离子化合物的电子式____________。
(7)元素②的氢化物的结构式为________;该氢化物常温下和元素②的最高价氧化物对应水化物反应的化学方程式为______________。
A、B、C、D、E、F六种短周期主族元素,其原子序数依次增大,其中B与C同周期,D与E 和F同周期,A与D同主族,C与F同主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的主族元素。又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。请回答下列问题:
(1)元素F在周期表中的位置________。
(2)C、D、F三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示)________。
(3)由A、B、C三种元素以原子个数比4:2:3形成化合物X,X中所含化学键类型有______。检验该化合物中的阳离子的方法是________(用离子方程式表示)。
(4)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出D元素的最高价氧化物对应的水化物与E的最高价氧化物反应的离子方程式:________________________。若E是非金属元素,其单质在电子工业中有重要应用,请写出其单质溶于强碱溶液的离子方程式:_______________。
I.A、B、C、D、E、F为常见的原子序数依次增大的短周期元素,B、C、D、E、F的简单离子的电子层结构相同,A和E同主族,且原子的最外层电子数的关系为A+D=B+F=8。请回答:
(1)试写出B2单质的电子式:________。试写出由上述元素组成的分子中含有4个原子核且为18电子结构的物质的化学式 。
(2)含F元素对应的金属阳离子的溶液中滴加过量E的最高价氧化物对应水化物的溶液,其离子方程式是________________。
(3)已知B2A4与BA3具有相似的性质,B2A4通过炽热的氧化铜粉末,粉末由黑色变为红色,且产物对大气无污染,其化学反应方程式是________________。
(4)在2 L的密闭容器中,通入2 mol B2气体和3 mol A2气体,一定温度下反应生成BA3 气体,当反应达到平衡时,A2的浓度为0.15 mol·L-1,同时放出约83.2 kJ的热量,该反应的热化学方程式为_____________。
(5)已知某化合物EB3与水可以反应生成两种气体单质和一种碱,试写出其化学方程式 ___________;若0.1 mol该化合物完全反应,转移电子的物质的量为________。
II.(1)甲、乙是元素周期表中同一主族相邻周期的两种元素(其中甲在上一周期),若甲的原子序数为x,则乙的原子序数可能是________。
(2)若甲、乙分别是同一周期的ⅡA族和ⅦA族元素,原子序数分别为m和n,则m和n的关系为________。
下表是元素周期表的短周期部分,表中字母分别表示一种元素。
请回答下列问题:
(1)g与b可形成离子化合物b2g2,该物质含有的化学键类型有 ________ 。
(2)e、f、g三种元素气态氢化物的稳定性由弱到强的顺序为(用化学式表示)________。
(3)从化合物c2g3与eg2组成的混合物中分离提纯eg2,可加入上述________(用元素符号表示)两种元素形成化合物的水溶液后再过滤洗涤。
(4)a、d两种元素可形成多种化合物,其中化合物X的产量是衡量一个国家石油化工发展水平的标志。X可与H2O在一定条件下反应生成化合物A,该反应的化学方程式为:________________________。
(5)航天技术中常使用a和g单质组成的燃料电池,该电池具有高能、轻便和不污染环境等优点。该电池反应为____________________。
下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0族 |
| 2 |
|
|
|
① |
② |
③ |
|
|
| 3 |
④ |
|
⑤ |
|
|
⑥ |
⑦ |
⑧ |
| 4 |
⑨ |
|
|
|
|
|
|
|
(1) 在这些元素中,化学性质最不活泼的是:_____________ (填具体元素符号,下同)。
(2) 在最高价氧化物的水化物中,酸性最强的化合物的分子式是_______,碱性最强的化合物的电子式是:_____________。
(3) 最高价氧化物是两性氧化物的元素是___________;写出它的氧化物与氢氧化钠反应的离子方程式________________________。
(4) 用电子式表示元素④与⑥形成的的化合物的形成过程______________________ ,该化合物属于__________________(填 “共价”或“离子”)化合物。
(5)元素①与⑦形成的的化合物的电子式为__________________,该化合物是由___________ (填“极性”“非极性”)键形成的。
下表列出了①~⑨九种元素在周期表中的位置。请回答(用化学用语):
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
|
|
|
⑤ |
|
⑥ |
|
|
| 3 |
① |
③ |
④ |
|
|
|
⑦ |
⑨ |
| 4 |
② |
|
|
|
|
|
⑧ |
|
(1)在这些元素中,最活泼的金属元素是 ;最活泼非金属元素是 ;最不活泼的元素是 。
(2)这些元素的最高价氧化物对应的水化物中,酸性最强的化合物的分子式是 ;碱性最强的化合物的电子式 ;能形成两性氢氧化物的元素是 。
(3)①、②、③三种元素的原子半径由大到小的顺序依次为 。
(4)⑥元素的氢化物是 ,该氢化物在常温下与②发生反应的化学方程式为 ,所得溶液的PH 7.
(5)用电子式表示 ①和⑧元素形成化合物的过程 。
元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是 。
a.原子半径和离子半径均减小
b.金属性减弱,非金属性增强
c.氧化物对应的水合物碱性减弱,酸性增强
d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为 ,氧化性最弱的简单阳离子是 。
(3)晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:
写出SiCl4的电子式: ;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,则生成1mol纯硅吸收的热量为
(4)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式: 。
试题篮
()