PCl5和AlCl3形成的加合物PCl5·AlCl3由[PCl4]+和[AlCl4]-构成。下列有关该加合物的叙述正确的是( )
| A.属于分子晶体 | B.[PCl4]+空间构型为正四面体 |
| C.阴阳离子均含有配位键 | D.固态可导电 |
下表是A、B、C、D、E、F六种短周期元素的部分化合价、电负性和原子半径数据。下列说法正确的是( )
| |
A |
B |
C |
D |
E |
F |
| 化合价 |
+1 |
-2 |
-1 |
-2 |
-1 |
+1 |
| 电负性 |
2.1 |
2.5 |
3.0 |
3.5 |
4.0 |
0.9 |
| 原子半径/nm |
0.037 |
0.102 |
0.099 |
0.073 |
0.071 |
0.154 |
A.A的单质中含有金属键 B.F2D2含有非极性共价键
C.沸点:A2D<AE D.最高价氧化物对应水化物的酸性:B>C
徐光宪在《分子共和国》一书中介绍了许多明星分子,如H2O2、CO2、BF3、CH3COOH等。下列说法正确的是( )
| A.H2O2分子的空间构型为直线形 | B.CO2分子为非极性分子 |
| C.BF3分子中的B原子满足8电子稳定结构 | D.CH3COOH分子中C原子均为sp2杂化 |
关于下列反应,说法正确的是:(图中共有三种原子)
| A.反应过程中E中共价键断裂,G中共价键保持不动 |
| B.E中存在非极性键 |
| C.M分子有可能是HCl |
| D.上述反应的类型是加成反应 |
下列物质既含离子键又含共价键的是
| A.HCl | B.NaCl | C.CaCl2 | D.Na2O2 |
短周期主族元素X、Y、Z、W的原子序数依次增大。X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与X同主族。下列说法正确的是
| A.原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X) |
| B.Y分别与Z、W形成的化合物中化学键类型相同 |
| C.X的最高价氧化物对应水化物的酸性比W的弱 |
| D.Y的气态简单氢化物的热稳定性比W的强 |
A、B、C、D、E为原子序数依次增大的短周期元素,B、C相邻且同周期,C原子中含有8种运动状态不同的电子。A、C能形成两种化合物甲和乙,原子个数比分别为2∶1和1∶1,甲为常见的溶剂。D是地壳中含量最多的金属元素。E元素为同周期电负性最大的元素。D和E可形成化合物丙。F为第四周期未成对电子数最多的元素。请回答下列问题:
(1)写出F基态原子的外围电子排布式 。
(2)B和C比较,第一电离能较大的元素是 (填元素符号)。
(3)甲、乙两分子中含有非极性共价键的是 (填分子式)。
(4)已知化合物丙熔点190℃,沸点183℃,结构如右图所示。

①丙属于 晶体。
②丙含有的作用力有 (填序号)。
A 离子键 B 共价键 C 金属键
D 配位键 E 范德华力
(5)F3+与元素A、C、E构成配合物戊,在含有0. 1mol戊的溶液中加入过量AgNO3溶液,经过滤、洗涤、干燥后,得到28.7g白色沉淀。已知该配合物的配位数为6,则戊的化学式为 。
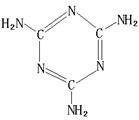
(6)三聚氰胺(结构如右图)由于其含氮量高被不法奶农添加到牛奶中来“提高”蛋白质的含量,造成全国许多婴幼儿因食用这种奶粉而患肾结石。三聚氰胺中N原子的杂化类型是 。
我国科学家研制出一种催化剂,能在室温下高效催化空气中甲醛的氧化,其反应如下:
HCHO+O2 CO2+H2O。下列有关说法正确的是
CO2+H2O。下列有关说法正确的是
| A.该反应为吸热反应 | B.CO2分子由极性键形成的极性分子 |
| C.HCHO分子中有3个σ键,1个π键 | D.每生成1.8gH2O消耗2.24L O2 |
通常情况下,NCl3是一种油状液体,其分子空间构型与氨分子相似,下列对NCl3的有关叙述正确的是
| A.分子中键角小于109.5。是因为氮原子轨道杂化类型为sp2杂化 |
| B.分子中的所有原子均达到8电子稳定结构 |
| C.NCl3分子是非极性分子 |
| D.NBr3比NCl3 易挥发 |
下列性质与氢键无关的是
| A.NH3的熔、沸点比第ⅤA族其他元素氢化物的熔、沸点高 |
| B.乙酸可以和水以任意比互溶 |
| C.常温下H2O为液态,而H2S为气态 |
| D.水分子高温下也很稳定 |
有关乙烯和苯分子中的化学键描述正确的是( )
| A.苯分子中每个碳原子的sp2杂化轨道中的其中一个形成大π键 |
| B.乙烯分子C-H之间是sp2形成的σ键,C-C之间是未参加杂化的2p轨道形成的π键 |
| C.苯分子C-C之间是sp2形成的σ键,C-H之间是未参加杂化的2p轨道形成的π键 |
| D.乙烯和苯分子每个碳原子都以sp2杂化轨道形成σ键,未杂化的2p轨道形成π键 |
试题篮
()