下列溶液中Cl-浓度最大的是( )
| A.10mL 0.2mol/L的FeCl3溶液 | B.30mL 0.25mol/L的FeCl2溶液 |
| C.20mL 0.2mol/L的KCl溶液 | D.10mL 0.3mol/L的AlCl3溶液 |
下列正确的叙述有
① CO2、NO2、P2O5均为酸性氧化物
② Ca(HCO3)2、Fe(OH)3、FeCl2均可由化合反应制得
③电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极
④灼热的炭与CO2的反应、Ba(OH)2·8H2O与NH4Cl的反应均既属于氧化还原反应,又是吸热反应
⑤需要通电才可进行的有:电离、电解、电泳、电镀、电化腐蚀
⑥氯化铁溶液与氢氧化铁胶体具有的共同性质是:能透过滤纸,加热蒸干、灼烧后都有氧化铁生成
⑦体积相同、pH相同的盐酸和醋酸溶液分别与锌粒反应,醋酸生成的氢气较多
⑧金属元素和非金属元素形成的化合物一定是离子化合物
| A.2个 | B.3个 | C.4个 | D.5个 |
现有等浓度的下列溶液:①醋酸,②苯酚,③苯酚钠,④碳酸,⑤碳酸钠,⑥碳酸氢钠。按溶液pH由小到大排列正确的是
| A.④①②⑤⑥③ | B.④①②⑥⑤③ | C.①④②⑥③⑤ | D.①④②③⑥⑤ |
将30 mL 0.5 mol·L-1 NaOH溶液加水稀释到500 mL,稀释后溶液中NaOH的物质的量浓度为
| A.0.3 mol·L-1 | B.0.03 mol·L-1 |
| C.0.05 mol·L-1 | D.0.04 mol·L-1 |
下列说法不正确的是
| A.凡是铵盐均能与苛性钠共热产生氨气 |
| B.向铜粉中加入稀硫酸,铜粉不溶解;再加入Cu(NO3)2固体,铜粉溶解 |
| C.将二氧化硫通入溴水,溴水退色后加热不能恢复原色 |
| D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高 |
下列说法错误的是( )
| A.从1L1mol/L的氯化钠溶液中取出10ml,其浓度仍是1mol/L |
| B.制成0.5L10mol/L的盐酸,需要氯化氢气体112L(标准状况) |
| C.0.5 L 2mol/L的氯化钡溶液中,钡离子和氯离子总数为3×6.02×1023 |
| D.10g 98%硫酸(密度为1.84g/cm3)与10mL18.4mol/L硫酸的浓度是不同的 |
200 ml Fe2(SO4)3溶液中含Fe3+ 56g,溶液中SO42—的物质的量浓度是( )
| A.5mol/L | B.7.5 mol/L | C.10 mol/L | D.2.5 mol/L |
密度为0.91 g·cm-3的氨水,质量分数为25%,若将此氨水用等体积的水稀释后,所得溶液的质量分数为 ( )
| A.大于12.5% | B.小于12.5% |
| C.等于12.5% | D.无法确定 |
等量镁铝合金粉末分别与下列4种过量的溶液充分反应,放出氢气最多的是 ( )
| A.2 mol·L-1H2SO4溶液 |
| B.18 mol·L-1H2SO4溶液 |
| C.6 mol·L-1KOH溶液 |
| D.3 mol·L-1HNO3溶液 |
某化学兴趣小组在家中进行化学实验,按照图甲连接好线路发现灯泡不亮,按照图乙连接好线路发现灯泡亮,由此得出的结论正确的是 ( )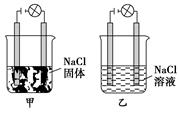
| A.NaCl是非电解质 |
| B.NaCl溶液是电解质 |
| C.NaCl是弱电解质 |
| D.NaCl在水溶液中电离出了可以自由移动的离子 |
在aLAl2(SO4)3和(NH4)2SO4的混合溶液分成两等分,一份加入bmol的BaCl2,恰好使溶液中的SO42-完全沉淀;另一份加入足量强碱并加热可得到cmolNH3,则原溶液中的Al3+的浓度(mol/L)为( )
A.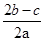 |
B.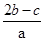 |
C.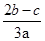 |
D.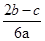 |
金属镁和0.1mol·L-1的HCl反应制取氢气,反应速率过快不易收集。为了减缓反应速率,又不减少产生氢气的量,加入下列试剂不能达到上述要求的是
| A.硫酸钠溶液 | B.醋酸钠固体 |
| C.碳酸钠固体 | D.水 |
将已污染的空气通入某溶液,测其导电性的变化,能获得某种污染气体的含量。如把含H2S的空气通入CuSO4溶液,导电性稍有变化但溶液吸收H2S的容量大;若用溴水,则吸收容量不大而导电性变化大。现要测量空气中的含氯量,并兼顾容量和导电性变化的灵敏度,最理想的吸收溶液是:
| A.NaOH溶液 | B.蒸馏水 | C.Na2SO3溶液 | D.KI溶液 |
试题篮
()