同体积同物质的量浓度的几种可溶性盐的溶液中,一定具有相同的( )
| A.溶质的物质的量 | B.溶质的质量 | C.溶质的摩尔质量 | D.离子总数 |
从1 L 1 mol/LNaOH溶液中取出100 ml,下列关于这100 ml溶液的叙述中错误的是
| A.含NaOH 0.1 mol | B.浓度为 1 mol/L |
| C.含NaOH 4g | D.浓度为0.1 mol/L |
已知反应:① 时,
时, ;
;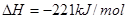
②稀溶液中,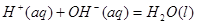 ;
;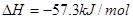
下列结论正确的是( )
A.稀醋酸与稀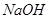 溶液反应生成 溶液反应生成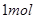 水,放出 水,放出 热量 热量 |
B.①的反应热为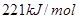 |
C.稀硫酸与稀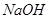 溶液反应的中和热为 溶液反应的中和热为 |
D.碳的燃烧热大于 |
室温下向10mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是
| A.溶液中导电粒子的数目减小 |
B.溶液中的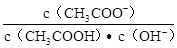 不变 不变 |
| C.醋酸的电离程度增大,c(H+)亦增大 |
| D.再加入10mL pH=11的NaOH溶液,混合液pH=7 |
取一张用饱和NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现电极与试纸接触处出现一个双色同心圆,内圆为白色,外圆呈浅红色。则下列说法错误的是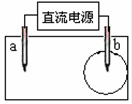
| A.b电极是阴极 |
| B.a电极与电源的正极相连接 |
| C.电解过程中,水是氧化剂 |
| D.b电极附近溶液的pH变小 |
常温下,用0.10 mol·L-1 KOH溶液滴定10.00 mL 0.10 mol·L-1H2C2O4(二元弱酸)溶液所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和)。下列说法正确的是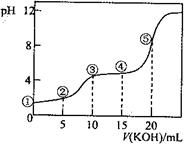
| A.点①所示溶液中: c(H+)/c(OH—)=1012 |
| B.点②所示溶液中: c(K+)+c(H+)=c(HC2O4—)+c(C2O42-)+c(OH—) |
| C.点③所示溶液中:c(K+)>c(HC2O4—)> c(H2C2O4)>c(C2O42-) |
| D.点④所示溶液中:c(K+)+ c(H2C2O4)+ c(HC2O4—) +c(C2O42-)=0.10mol·L-1 |
向CH3COONa稀溶液中分别加入少量下列物质或改变如下条件,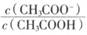 一定减小的是
一定减小的是
①NaOH固体②NaHSO4固体③氯化钠水溶液
④CH3COONa固体⑤冰醋酸⑥降低温度
| A.①③④ | B.②③⑤ | C.②⑤⑥ | D.①④⑥ |
在一固定体积的密闭容器中加入2molA和1molB发生反应2A(g)+B(g)  3C(g)+D(g),达到平衡时C的浓度为w mol·L-1,若维持容器的体积和温度不变,按下列四种配比方案作为反应物,达平衡后,使C的浓度仍为w mol·L-1的配比是( )
3C(g)+D(g),达到平衡时C的浓度为w mol·L-1,若维持容器的体积和温度不变,按下列四种配比方案作为反应物,达平衡后,使C的浓度仍为w mol·L-1的配比是( )
| A.4 mol A+2 mol B | B.3 mol C+1 mol D+2mol A+1 mol B |
| C.3mol C+1 mol D+1 mol B | D.3 mol C+1 mol D |
下列各反应的化学方程式中,属于水解反应的是( )
A.H2O+ H2O  H3O++OH- H3O++OH- |
B.HCO3-+OH- H2O+CO32- H2O+CO32- |
C.CO2+H2O H2CO3 H2CO3 |
D.CO32-+H2O HCO3-+OH- HCO3-+OH- |
将0.1 mol下列物质置于1 L水中充分搅拌后,溶液中阴离子数最多的是 ( )
| A.KCl | B.Mg(OH)2 | C.Na2CO3 | D.MgSO4 |
常温下pH均为2的两种酸溶液X和Y各10 mL分别加水稀释到10000 mL,其pH与所加水的体积变化如图所示,下列结论中正确的是
| A.加水后,Y酸的电离度增大 |
| B.X酸在水溶液中存在电离平衡 |
| C.加水后,X酸的电离平衡常数减小 |
| D.X酸的物质的量浓度与Y酸的物质的量浓度相等 |
下列方法能使电离平衡H2O H+ + OH-向左移动的是
H+ + OH-向左移动的是
| A.向水中加入少量氢氧化钠固体 | B.向水中加入少量硫酸铝固体 |
| C.向水中加入少量碳酸钠固体 | D.将水加热到100℃,使水的pH=6 |
向蒸馏水中滴入少量稀盐酸后,下列说法正确的是
| A.c(H+)·c(OH-)比值不变 | B.溶液pH增大 |
| C.c(OH-)降低了 | D.水电离出的c(H+)增加了 |
试题篮
()