(9分) 已知有关物质的氧化性强弱顺序为:浓硫酸>Fe3+>H+>Fe2+。称得 60 g 铁粉与100 mL 浓硫酸在加热的条件下反应,反应最终有固体剩余,共收集到标准状况下气体22.4 L,气体的质量为39.2 g。试回答以下问题:(又知:2Fe 3++ Fe = 3Fe2+)
(1)在加热的条件下开始反应到最终有固体剩余,还涉及到的化学方程式有:
_______________________________________________________________________;
(2)求浓硫酸的物质的量浓度;
(3)反应最终剩余固体的质量。(写出简单的计算过程)
(7分) 由Cl-、Br-、CO32-、SO32-、SO42-、Na+、Fe3+中若干种离子组成的化合物溶于水后得无色溶液,然后依次进行实验,观察到的现象记录如下:
①向溶液中加足量新制饱和的氯水,溶液变黄,无气体产生,再加入汽油振荡,静置,汽油层呈橙红色,用分液漏斗分离。
②向分液后所得的水溶液中加入BaCl2和盐酸的混合溶液,有白色沉淀产生,过滤。
③在滤液中加入AgNO3和HNO3的混合液,有白色沉淀产生。
请认真分析后回答下列问题:
(1)原溶液中是否含有Na+ (填“是”“否”或“无法确定”,下同。),原溶液中是否含有Cl- 。
(2)步骤①中溶液变黄的原因是(用离子方程式表示):
______________________________________________________________________。
(3)原溶液中是否含有SO32-、SO42-: (填“都有”、“都没有”、“仅有一种”或“至少有一种”)。理由是_____________________________________________________。
在常温下,用一定浓度的CH3COOH溶液滴定V mL同浓度NaOH溶液时得到的滴定曲线如下图: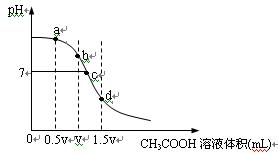
经测定某溶液中只含有Na+、CHCOO-、H+、OH- 四种离子,已知这种溶液含有一种或两种溶质。查资料表明等浓度的CH3COOH和CH3COONa的混合液显酸性。试完成下列各题:
(1)试分析上图所表示滴定过程的b、d两点可能的溶质组合:
b点_____________________,d点____________________。
(2)分别指出上图a、c两点所存在的微粒的离子浓度大小关系:
a点:_________________________________________________________________________
c点:_________________________________________________________________________
(3)水的电离程度与溶液中所溶解的电解质有关,试分析上图a、b、c、d点,水的电离程度最大的是______。
(4)有关这种溶液,下列的说法不正确的是_________
| A.若溶液中粒子间满足:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),则溶液中溶质可能为CH3COONa和NaOH |
| B.若溶液中粒子间满足c(CH3COO-)>c(Na+)>c(H+)>c (OH-),则溶液中溶质一定只有CH3COONa |
| C.若溶液中c(Na+)=c(CH3COO-),则该溶液一定显中性 |
| D.若溶液中c(CH3COOH)>c(Na+),则溶液一定显酸性 |
E.溶液中离子间可能满足c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
(5)若溶液是由体积相等的CH3COOH溶液和NaOH溶液混合而成,且恰好呈中性,则混合前c(CH3COOH)____________c(NaOH)(填“>”“<”或“=”)。
将0.l mol∙L-1的下列物质的水溶液,从常温加热到80℃,溶液的pH不变的是
| A.NaCl | B.NaOH | C.H2SO4 | D.NH4Cl |
(1)某温度(t℃)时,水的Kw=10-13mol2·L-2,则该温度(填大于、小于或等于) 25℃,其理由是 。
(2)将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4的溶液bL混合,则:
①若所得混合液为中性,则a∶b= ;
②若所得混合液的pH=2,则a∶b= ;
在相同温度下,等体积、等物质的量浓度的下列溶液①Na2SO4、②H2SO3、③NaHSO3、④Na2S中,所含带电微粒数由多到少的顺序为( )
A ④>①>③>② B ①>④>③>②
C ①=④>②=③ D ④=①>③>②
饮用水安全状况与人类健康有着密切关系。重金属离子对河流、海洋会造成严重污染。沉淀法是处理含重金属离子污水常用的方法。
某工厂废水(pH=2.0,ρ=1.0 g·mL-1)中含Ag+、Pb2+等重金属离子,其浓度各约为0.01mol·L-1。排放前拟用沉淀法除去这两种离子,查找有关数据如下:
| 难溶电解质 |
AgCl |
AgI |
AgOH |
Ag2S |
PbI2 |
Pb(OH)2 |
PbS |
| Ksp |
1.8×10-10 |
8.3×10-17 |
5.6×10-18 |
6.3×10-50 |
7.1×10-9 |
1.2×10-15 |
3.4×10-28 |
(1)你认为往废水中投 (填字母序号),沉淀效果最好。
| A.NaOH | B.Na2S | C.KI | D.Ca(OH)2 |
 (2)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)= 。
(2)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)= 。 (3)如果用食盐处理其只含银离子的废水,测得处理后的废水中NaCl的质量分数为0.117%,若环境要求排放标准为c(Ag+)低于1.0×10-18mol·L-1,则该工厂处理后的废水是否符合排放标准 。
(3)如果用食盐处理其只含银离子的废水,测得处理后的废水中NaCl的质量分数为0.117%,若环境要求排放标准为c(Ag+)低于1.0×10-18mol·L-1,则该工厂处理后的废水是否符合排放标准 。 (填“是”或 “否”)写出计算过程。
(填“是”或 “否”)写出计算过程。
常温下,甲、乙两杯醋酸的稀溶液,甲的pH=2,乙的pH=3,对下列叙述的判断不正确的是
| A.甲中水电离出的H+的物质的量浓度是乙中水电离出的H+的物质的量浓度的1/10 | |
| B.物质的量浓度c(CH3COOH)甲>10c(CH3COOH)乙 | |
| C.中和等量NaOH溶液需甲乙两杯醋酸溶液的体积:10V(CH3COOH)甲>V(CH3COOH)乙 | D.甲中的c(OH-)为乙中c(OH-)的1/10 |
已知相同条件下HBrO比H2CO3酸性弱,HCO3-比HBrO难电离,则下列说法不正确的是
| A.结合质子的能力:CO32->BrO- |
| B.相同浓度时溶液的碱性:NaBrO > NaHCO3 |
| C.反应CO2+NaBrO+H2O→NaHCO3+HBrO可以发生 |
| D.反应CO2+2NaBrO+H2O→Na2CO3+2HBrO可以发生 |
下列有关离子浓度的关系正确的是
A. 0.1mol·L-1的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-)
B.浓度均为0.1mol/L的 CH3COOH和CH3COONa溶液等体积混合
c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)]
C.0.1mol/L NaHA溶液的pH="3: " c(HA一) >c(H+) >c(H2A)>c(A2-)
D.新制氯水中c(Cl2)=2[c(ClO—)+c(Cl—)+c(HClO)]
常温下,Ksp(CaS04)=9×l0-6,常温下CaS04在水中的沉淀溶解平衡曲线如图。下列说法正确的是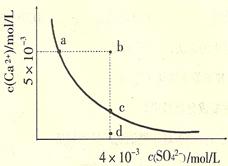
| A.常温下CaSO4饱和溶液中,c(Ca2+)、c(SO42-)对应曲线上任意一点 |
| B.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×l0-3mol/L |
| C.d点溶液通过蒸发可以变到c点 |
| D.a点对应的Ksp等于c点对应的Ksp |
已知NaHSO4在水中的电离方程式为:NaHSO4=Na++H++SO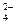 .某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2.下列对该溶液的叙述中不正确的是
.某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2.下列对该溶液的叙述中不正确的是
| A.该温度下加入等体积pH为12的NaOH溶液可使该溶液恰好呈中性 |
| B.由水电离出来的H+的浓度是1.0×10-10mol·L-1 |
| C.NaHSO4晶体的加入抑制了水的电离 |
| D.c(H+)=c(OH-)+c(SO42-) |
下列离子方程式正确的是
A.氯化铝溶液水解显酸性:Al3++3H2O Al(OH)3↓+3H+ Al(OH)3↓+3H+ |
| B.向漂白粉溶液中通入SO2气体:Ca2++2C1O-+SO2 +H2O= CaSO3↓+2HC1O |
C.用石墨作电极电解CuCl2溶液:2C1-+2H2O Cl2↑+H2↑+2OH- Cl2↑+H2↑+2OH- |
| D.含有等物质的量的氢氧化钡、明矾两种溶液混合: |
3Ba2++6OH-+2A13++3SO42-=3BaSO4↓+2Al(OH)3↓[
下列溶液中各微粒的浓度关系不正确的是()
| A. |
0.1
|
| B. |
1 L 0.1
|
| C. |
0.1
|
| D. | 等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中: |
试题篮
()