取一张用饱和NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现电极与试纸接触处出现一个双色同心圆,内圆为白色,外圆呈浅红色。则下列说法错误的是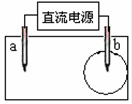
| A.b电极是阴极 |
| B.a电极与电源的正极相连接 |
| C.电解过程中,水是氧化剂 |
| D.b电极附近溶液的pH变小 |
室温时,向稀醋酸中逐滴加入NaOH溶液,正确的是:
| A.向原醋酸中滴入NaOH溶液,可促进CH3COOH的电离,溶液的pH降低 |
| B.当滴入的NaOH与CH3COOH恰好反应时,所得溶液呈中性 |
C.当两者恰好完全反应时: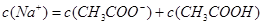 |
D.所得溶液中各离子浓度的关系为: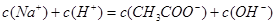 |
向CH3COONa稀溶液中分别加入少量下列物质或改变如下条件,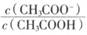 一定减小的是
一定减小的是
①NaOH固体②NaHSO4固体③氯化钠水溶液
④CH3COONa固体⑤冰醋酸⑥降低温度
| A.①③④ | B.②③⑤ | C.②⑤⑥ | D.①④⑥ |
下列溶液中微粒的物质的量浓度关系正确的是 ( )
| A.室温下,向0.01 mol·L-1 NH4HSO4溶液中滴加NaOH溶液至中性: c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
| B.25℃时,pH =4.75、浓度均为0.1 mol·L-1的CH3COOH、CH3COONa的混合液: c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+) |
| C.25℃时,pH=2的HCOOH与pH=12的NaOH等体积混合: c(HCOO-)+c(H+)<c(Na+)+c(OH-) |
| D.0.1 mol/L Na2CO3溶液与0.1mol/L NaHCO3溶液等体积混合: |
2 c (CO32-)+2 c (HCO3-)+2 c (H2CO3)="3" c (Na+)
下列各反应的化学方程式中,属于水解反应的是( )
A.H2O+ H2O  H3O++OH- H3O++OH- |
B.HCO3-+OH- H2O+CO32- H2O+CO32- |
C.CO2+H2O H2CO3 H2CO3 |
D.CO32-+H2O HCO3-+OH- HCO3-+OH- |
25℃时,水中存在电离平衡:H2O  H++OH- ΔH>0。下列叙述正确的是
H++OH- ΔH>0。下列叙述正确的是
| A.将水加热,Kw增大,pH不变 |
| B.向水中加入少量NaHSO4固体,c(H+)增大,Kw不变 |
| C.向水中加入少量NaOH固体,平衡逆向移动,c(OH-)降低 |
| D.向水中加入少量NH4Cl固体,平衡正向移动,c(OH-)增大 |
常温下pH均为2的两种酸溶液X和Y各10 mL分别加水稀释到10000 mL,其pH与所加水的体积变化如图所示,下列结论中正确的是
| A.加水后,Y酸的电离度增大 |
| B.X酸在水溶液中存在电离平衡 |
| C.加水后,X酸的电离平衡常数减小 |
| D.X酸的物质的量浓度与Y酸的物质的量浓度相等 |
在25mL0.1mol∙L-1 NaOH溶液中逐滴加入0.1mol∙L-1 CH3COOH溶液,曲线如右图所示,有关粒子浓度关系正确的是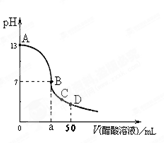
A.在A、B间任一点,溶液中一定都有c(Na+)+c(H+)=c(CH3COO-)+(OH-)
B.在B点,a>25,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C.在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.在D点:c(CH3COO-)+c(CH3COOH)=c(Na+)
有一种非常活泼的碱金属的酸式盐AHB,它的水溶液呈弱碱性,现有下列说法,其中正确的是
A.该盐的电离方程式为:AHB A+ + HB- A+ + HB- |
| B.HB-的电离程度大于HB-的水解程度 |
| C.同浓度的AOH溶液和H2B溶液,电离程度:前者大于后者 |
| D.在溶液中离子浓度大小顺序为:c(A+)> c(OH-)>c(HB-) >c(H+)>c(B2-) |
在200 mL某硫酸盐溶液中,含有1.5 NA个硫酸根离子(NA表示阿伏加德罗常数的值),同时含有NA个金属离子。则该硫酸盐的物质的量浓度为( )
A.2 mol·L-1 B.2.5 mol·L-1 C.5 mol·L-1 D.7.5 mol·L-1
室温下,将1.00mol· L-1盐酸滴入20.00mL1.00mol· L-1氨水中,溶液pH随加入盐
酸体积变化曲线如图所示。下列有关说法正确的是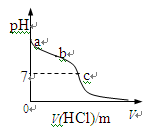
| A.a点:pH=14 |
| B.b点:c(NH4+) +c(NH3·H2O) = c(Cl-) |
| C.c点:水电离出的c(H+) = 1.0×10-7mol· L-1 |
| D.c点后,溶液中离子浓度大小关系一定为: |
c(Cl-)>c(NH4+)>c(H+)>c(OH-)
Mg(ClO3)2在农业上常用作脱叶剂、催熟剂,可采用复分解反应制备:MgCl2+2NaClO3=Mg(ClO3)2+2NaCl。已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示。下列叙述正常的是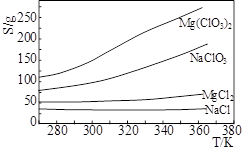
| A.四种化合物的溶解度随温度变化最小的是Mg(ClO3)2 |
| B.300K时,MgCl2的溶解度约为55g |
| C.300K时,100gNaCl饱和溶液中约含有NaCl 36g |
| D.该反应能够进行的条件是生成沉淀,该沉淀是Mg(ClO3)2 |
室温下,向pH=13的氢氧化钡溶液中加入等体积的下列溶液后,滴入石蕊试液,出现蓝色,该溶液可能是:
| A.0.05 mol·L-1的硫酸溶液 |
| B.0.1 mol·L-1的硫酸钠溶液 |
| C.pH=1的醋酸溶液 |
| D.pH=1的盐酸 |
试题篮
()