用惰性电极电解下列溶液一段时间后,停止电解,向溶液中加入一定质量的另一种物质(括号内),可能使溶液完全复原的是
| A.CuCl2 (CuO) | B.NaOH (NaOH) |
| C.CuSO4 (Cu(OH)2 ) | D.NaCl (Cl2) |
下列有关的叙述正确的是
| A.常温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为 c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| B.将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 |
| C.用pH=3和pH=2的醋酸溶液中和含等量NaOH的溶液所消耗的醋酸溶液的体积分别为Va和Vb,则Va>10Vb |
| D.Na2BeO2溶液的pH>7,BeCl2溶液的pH<7,分别将它们蒸干并灼烧后,都可能生成BeO |
如图所示,将两烧杯用导线如图相连,Pt、Cu、Zn、C分别为四个电极,当闭合开关后,以下叙述正确的是 
| A.Cu极附近OH-浓度增大 |
| B.Cu极为原电池负极 |
| C.电子流向是由C极流向Pt极 |
| D.当C极上有4 mol电子转移时,Pt极上有1 mol O2生成 |
浓度都是0.1 mol·L-1的弱酸HX溶液与NaX溶液等体积混合后,在所得溶液中,有关离子浓度的关系错误的是( )
| A.C(Na+)+C(H+)=C(X-)+C(OH-) |
| B.C(X-)+ C(HX)=2C(Na+) |
| C.若混合物呈酸性, 则C(X-)>C(Na+)>C(HX)>C(H+)>C(OH-) |
| D.若混合物呈碱性, 则C(Na+)>C(HX)>C(X-)>C(OH-)>C(H+) |
已知下面三个数据:7.2×10-4 mol·L-1、4.6×10-4 mol·L-1、4.9×10-10 mol·L-1分别是下列有关的三种酸的电离常数的数值,若已知下列反应可以发生:
NaCN+HNO2===HCN+NaNO2 NaCN+HF===HCN+NaF
NaNO2+HF===HNO2+NaF,由此可判断下列叙述不正确的是
| A.NaCN和HCN 物质的量比1︰1组成的混合溶液呈酸性 |
| B.物质的量浓度均为0.1mol·l-1的NaF、NaNO2、NaCN溶液的pH逐渐增大 |
| C.根据上述某两个反应即可得出电离常数大小的结论 |
| D.电离常数为:K(HCN)<K(HNO2)<K(HF) |
下列说法正确的是( )
| A.物质的量浓度相同的NH4Cl和NH4HSO4两种溶液中,c(NH)前者小于后者 |
| B.Al3+、NO3-、Cl-、CO32-、Na+可大量共存于pH=2的溶液中 |
| C.分别与等物质的量的HCl和H2SO4反应时,消耗NaOH的物质的量相同 |
| D.乙醇和乙酸都能溶于水,都是电解质 |
某温度下,相同体积、相同pH的盐酸和醋酸溶液分别加水稀释,溶液pH随体积变化的曲线如图所示。据图判断下列说法正确的是 (  )
)
| A.Ⅱ为盐酸稀释时的pH变化曲线 |
| B.b点溶液的导电性比c点溶液的导电性强 |
C.a点K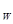 的数值比c点K 的数值比c点K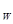 的数值大 的数值大 |
| D.b点酸的总浓度大于a点酸的总浓度 |
下列关于电解质溶液的叙述正确的是
| A.常温下物质的量浓度相等①NH4HSO4、②(NH4)2SO4、③(NH4)2CO3三种溶液中c(NH4+)①<②<③ |
| B.在纯水中加入少量硫酸或硫酸铵,均可抑制水的电离 |
| C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 |
| D.常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大 |
关于浓度均为0.1 mol·L-1的三种溶液:①CH3COOH、②NaOH、③CH3COONa溶液,下列说法不正确的是
| A.c(CH3COO-):③>① |
| B.水电离出的c(OH-):②>① |
| C.①和②等体积混合后的溶液:c(OH-)=c(H+)+c(CH3COOH) |
| D.①和③无论以何种比例混合,混合后的溶液:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
在0.10mol·L-1NH3·H2O溶液中,加入少量NH4Cl晶体后,引起的变化是
| A.NH3·H2O的电离程度减小 |
| B.NH3·H2O的电离常数增大 |
| C.溶液的导电能力不变 |
| D.溶液的pH增大 |
下列有关沉淀溶解平衡的说法中,正确的是( )
A. Ksp(AB2)小于Ksp(CD),说明AB2的溶解度小于CD的溶解度
B.在氯化银的沉淀溶解平衡体系中加入蒸馏水,氯化银的Ksp增大
C.在碳酸钙的沉淀溶解平衡体系中加入稀盐酸,沉淀溶解平衡不移动
D.向氯化银沉淀溶解平衡体系中加人碘化钾固体,氯化银沉淀可转化为碘化银沉淀
下列有关平衡常数的说法正确的是( )
A.已知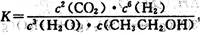 ,则对应的化学反应可以表示为: ,则对应的化学反应可以表示为:2CO2( g) + 6H2(g)  CH3CH2OH(g) + 3H2O(g) CH3CH2OH(g) + 3H2O(g) |
| B.将某浓度氢氟酸溶液升高温度,氢氟酸的电离平衡常数Ka将变大 |
| C.常温下,向纯水中加入碳酸钠,水的电离程程度变大,Kw变大 |
| D.化学平衡常数K与温度有关,随温度的升高,K可能增大也可能减小,或者不变 |
20ml 1mol/LCH3COOH溶液跟40ml 0.5mol/LNaOH溶液相混合,所得溶液中离子浓度由大到小的顺序是( )
| A.c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| B.c(Na+)=c(CH3COO-),c(CH3COO-)>c(OH-)>c(H+) |
| C.c(Na+)>c(OH-)>c(CH3COO-)>c(H+)>c(CH3COO-) |
| D.c(Na+)>c(OH-)>c(H+)>c(CH3COO-) |
试题篮
()