在a LAl2(SO4)3和(NH4)2SO4的混合溶液中加入 ,恰好使溶液中的SO42—离子完全沉淀;如加入足量强碱并加热可得到c mol NH3,则原溶液中的Al3+浓度(mol/L)为( )
,恰好使溶液中的SO42—离子完全沉淀;如加入足量强碱并加热可得到c mol NH3,则原溶液中的Al3+浓度(mol/L)为( )
A. |
B. |
C. |
D. |
已知复分解反应:2 CH3COOH+Na2CO3==2CH3COONa+ H2O+CO2↑可自发进行。在常温下,测得浓度均为0.1mol/L的下列六种溶液的PH:
| 溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
| PH值 |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
表中数据提示出复分解反应的一条规律,即碱性较强的物质发生类似反应可生成碱性较弱的物质。依据该规律,请你判断下列反应不能成立的是:
| A.CO2 +H2O+ NaClO="=" NaHCO3+HClO | B.CO2 +H2O+ 2NaClO="=" Na2CO3+2HClO |
| C.CH3COOH+ NaCN="=" CH3COONa+HCN | D.CH3COOH+ NaClO="=" CH3COONa+ HClO |
已知在一密闭绝热容器中,饱和石灰水中存在平衡:Ca(OH)2(s) 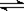 Ca2+(aq)+2OH-(aq),现向其中加入少量CaO粉末,则下列说法错误的是:
Ca2+(aq)+2OH-(aq),现向其中加入少量CaO粉末,则下列说法错误的是:
| A.析出固体的质量增加 | B.溶液的pH值不变 |
| C.溶液中的OH-数目减少 | D.溶液中的Ca2+浓度减小 |
向一定量的K2CO3溶液中缓慢滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中离子数目也相应地发生变化。如图所示,四条曲线与溶液中的离子的对应关系,完全正确的是 ( )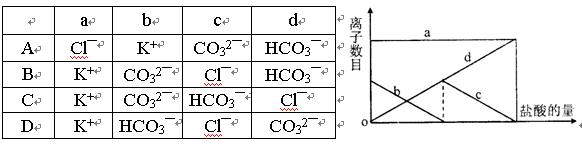
下列关于电解质的叙述,正确的是
| A.Cl2的水溶液能导电,但Cl2的是非电解质 |
| B.0.1mol/L的氨水可以使酚酞试液变红,说明氨水是弱电解质 |
| C.向pH=12的NaOH溶液通电一段时间溶液的pH>12 |
| D.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 |
将0.l mol∙L-1的下列物质的水溶液,从常温加热到80℃,溶液的pH不变的是
| A.NaCl | B.NaOH | C.H2SO4 | D.NH4Cl |
在相同温度下,等体积、等物质的量浓度的下列溶液①Na2SO4、②H2SO3、③NaHSO3、④Na2S中,所含带电微粒数由多到少的顺序为( )
A ④>①>③>② B ①>④>③>②
C ①=④>②=③ D ④=①>③>②
常温下,甲、乙两杯醋酸的稀溶液,甲的pH=2,乙的pH=3,对下列叙述的判断不正确的是
| A.甲中水电离出的H+的物质的量浓度是乙中水电离出的H+的物质的量浓度的1/10 | |
| B.物质的量浓度c(CH3COOH)甲>10c(CH3COOH)乙 | |
| C.中和等量NaOH溶液需甲乙两杯醋酸溶液的体积:10V(CH3COOH)甲>V(CH3COOH)乙 | D.甲中的c(OH-)为乙中c(OH-)的1/10 |
已知相同条件下HBrO比H2CO3酸性弱,HCO3-比HBrO难电离,则下列说法不正确的是
| A.结合质子的能力:CO32->BrO- |
| B.相同浓度时溶液的碱性:NaBrO > NaHCO3 |
| C.反应CO2+NaBrO+H2O→NaHCO3+HBrO可以发生 |
| D.反应CO2+2NaBrO+H2O→Na2CO3+2HBrO可以发生 |
下列有关离子浓度的关系正确的是
A. 0.1mol·L-1的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-)
B.浓度均为0.1mol/L的 CH3COOH和CH3COONa溶液等体积混合
c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)]
C.0.1mol/L NaHA溶液的pH="3: " c(HA一) >c(H+) >c(H2A)>c(A2-)
D.新制氯水中c(Cl2)=2[c(ClO—)+c(Cl—)+c(HClO)]
常温下,Ksp(CaS04)=9×l0-6,常温下CaS04在水中的沉淀溶解平衡曲线如图。下列说法正确的是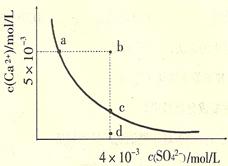
| A.常温下CaSO4饱和溶液中,c(Ca2+)、c(SO42-)对应曲线上任意一点 |
| B.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×l0-3mol/L |
| C.d点溶液通过蒸发可以变到c点 |
| D.a点对应的Ksp等于c点对应的Ksp |
已知NaHSO4在水中的电离方程式为:NaHSO4=Na++H++SO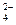 .某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2.下列对该溶液的叙述中不正确的是
.某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2.下列对该溶液的叙述中不正确的是
| A.该温度下加入等体积pH为12的NaOH溶液可使该溶液恰好呈中性 |
| B.由水电离出来的H+的浓度是1.0×10-10mol·L-1 |
| C.NaHSO4晶体的加入抑制了水的电离 |
| D.c(H+)=c(OH-)+c(SO42-) |
下列离子方程式正确的是
A.氯化铝溶液水解显酸性:Al3++3H2O Al(OH)3↓+3H+ Al(OH)3↓+3H+ |
| B.向漂白粉溶液中通入SO2气体:Ca2++2C1O-+SO2 +H2O= CaSO3↓+2HC1O |
C.用石墨作电极电解CuCl2溶液:2C1-+2H2O Cl2↑+H2↑+2OH- Cl2↑+H2↑+2OH- |
| D.含有等物质的量的氢氧化钡、明矾两种溶液混合: |
3Ba2++6OH-+2A13++3SO42-=3BaSO4↓+2Al(OH)3↓[
下列溶液中各微粒的浓度关系不正确的是()
| A. |
0.1
|
| B. |
1 L 0.1
|
| C. |
0.1
|
| D. | 等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中: |
试题篮
()