下列事实中,能证明氯化氢是共价化合物的是( )
| A.氯化氢易溶于水 | B.氯化氢的水溶液能导电 |
| C.液态氯化氢不导电 | D.氯化氢受热不易分解 |
下列电离方程式中,正确的是
| A.Ba(OH)2 =Ba2++ (OH)- | B.FeCl3=Fe2++3Cl- |
| C.H2SO4 =H2++SO42- | D.Al2(SO4)3=2Al3++3SO42- |
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的( )
| A.NaOH(固体) | B.H2O | C.NH4Cl(固体) | D.CH3COONa(固体) |
室温下向10mL pH=3的醋酸溶液中加入水稀释后,下列说法正确的是
| A.溶液中导电粒子的数目减少 |
B.溶液中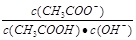 不变 不变 |
| C.醋酸的电离程度增大,c(H+)亦增大 |
| D.完全中和醋酸需加入10mLpH=11的NaOH溶液 |
某固体化合物A不导电,但熔化或溶于水都能完全电离。下列关于物质A的说法中,正确的是( )
| A.A为非电解质 | B.A是强电解质 |
| C.A是离子晶体 | D.A是弱电解质 |
向15mL 0.1mol·L-1KOH溶液中逐滴加入0.2 mol·L-1甲酸(HCOOH,一元弱酸)溶液,溶液pH和加入的甲酸的体积关系曲线如右图所示,有关粒子浓度大小关系正确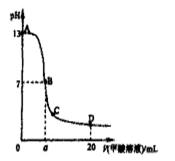
A.在A、B间任意一点c(K+) > c(HCOO-) > c(OH-) > c(H+)
B.在B点:c(K+) = c(HCOO-) > c(OH-) = c(H+),且a=7.5
C.在C点:c(HCOO-) > c(K+) > c(OH-) > c(H+)
D.在D点:c(HCOO-) + c(HCOOH) > 2c(K+)
同体积同物质的量浓度的几种可溶性盐的溶液中,一定具有相同的( )
| A.溶质的物质的量 | B.溶质的质量 | C.溶质的摩尔质量 | D.离子总数 |
在200 mL某硫酸盐溶液中,含有1.5 NA个硫酸根离子(NA表示阿伏加德罗常数的值),同时含有NA个金属离子。则该硫酸盐的物质的量浓度为( )
A.2 mol·L-1 B.2.5 mol·L-1 C.5 mol·L-1 D.7.5 mol·L-1
室温下,将1.00mol· L-1盐酸滴入20.00mL1.00mol· L-1氨水中,溶液pH随加入盐
酸体积变化曲线如图所示。下列有关说法正确的是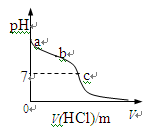
| A.a点:pH=14 |
| B.b点:c(NH4+) +c(NH3·H2O) = c(Cl-) |
| C.c点:水电离出的c(H+) = 1.0×10-7mol· L-1 |
| D.c点后,溶液中离子浓度大小关系一定为: |
c(Cl-)>c(NH4+)>c(H+)>c(OH-)
Mg(ClO3)2在农业上常用作脱叶剂、催熟剂,可采用复分解反应制备:MgCl2+2NaClO3=Mg(ClO3)2+2NaCl。已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示。下列叙述正常的是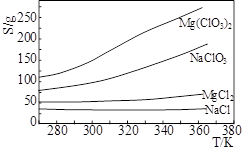
| A.四种化合物的溶解度随温度变化最小的是Mg(ClO3)2 |
| B.300K时,MgCl2的溶解度约为55g |
| C.300K时,100gNaCl饱和溶液中约含有NaCl 36g |
| D.该反应能够进行的条件是生成沉淀,该沉淀是Mg(ClO3)2 |
室温下,向pH=13的氢氧化钡溶液中加入等体积的下列溶液后,滴入石蕊试液,出现蓝色,该溶液可能是:
| A.0.05 mol·L-1的硫酸溶液 |
| B.0.1 mol·L-1的硫酸钠溶液 |
| C.pH=1的醋酸溶液 |
| D.pH=1的盐酸 |
pH=11的x、y两种碱溶液各5mL,分别稀释至500mL,其pH与溶液体积(V)的关系如图所示,下列结论正确的是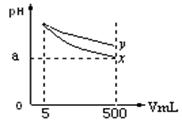
| A.相同温度下,x的电离平衡常数小于y |
| B.若x、y是一元碱,等物质的量浓度的盐酸盐溶液,y的pH大 |
| C.若x、y都是弱碱,则a的值一定大于9 |
| D.完全中和x,y两溶液时,消耗同浓度稀硫酸的体积V(x)>V(y) |
向三份0.1 mol/L CH3COONa溶液中分别加入少量NH4NO3、Na2SO3、FeCl3固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为
| A.减小、增大、减小 | B.增大、减小、减小 |
| C.减小、增大、增大 | D.增大、减小、增大 |
试题篮
()