升高温度,下列常数中不一定增大的是
| A.平衡常数K | B.电离常数Ka |
| C.水的离子积常数Kw | D.盐的水解常数Kh |
下列图示与对应的叙述相符的是 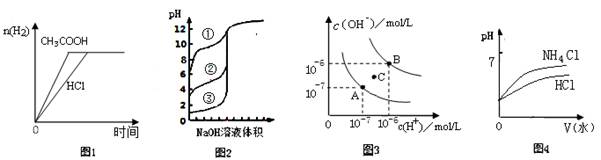
| A.图1中曲线表示向等体积、等物质的量浓度的盐酸和醋酸溶液中,分别加入足量镁粉,产生H2的物质的量的变化 |
| B.图2表示用0.1000mol/LNaOH溶液分别滴定浓度相同的三种一元酸,由曲线可确定③的酸性最强 |
| C.图3为水的电离平衡曲线图,若从A点到C点,可采用在水中加入适量NaOH固体的方法 |
| D.图4表示将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数时,二者 pH的变化 |
含等物质的量NaOH的溶液分别用pH为2和3的CH3COOH溶液中和,设消耗CH3COOH溶液的体积依次为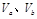 ,则两者的关系正确的是
,则两者的关系正确的是
A.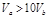 |
B.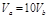 |
C.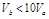 |
D.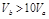 |
在HNO3、Al(NO3)3和Mg(NO3)2的混合溶液中逐滴加入NaOH溶液,则消耗NaOH溶液的体积(x轴)与生成沉淀(y轴)之间的关系表示正确的是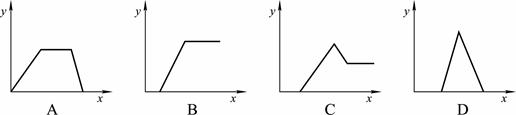
有100 mL 3 mol·L-1的氢氧化钠溶液和100 mL 1 mol·L-1的氯化铝溶液。按如下两种方法进行实验:
①将氢氧化钠溶液分多次加入到氯化铝溶液中;
②将氯化铝溶液分多次加入到氢氧化钠溶液中。
比较两次实验,结果是( )
| A.现象相同,最终沉淀量相等 | B.现象不同,最终沉淀量不相等 |
| C.现象相同,最终沉淀量不相等 | D.现象不同,最终沉淀量相等 |
在密闭容器中进行X2(g)+4Y2(g)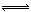 2Z2(g)+3Q2(g)的反应,其中X2、Y2、Z2、Q2的起始浓度分别是0.1mol·L-1、0.4mol·L-1、0.2mol·L-1、0.3mol·L-1当反应达到平衡后,各物质的物质的量浓度不可能是
2Z2(g)+3Q2(g)的反应,其中X2、Y2、Z2、Q2的起始浓度分别是0.1mol·L-1、0.4mol·L-1、0.2mol·L-1、0.3mol·L-1当反应达到平衡后,各物质的物质的量浓度不可能是
| A.c(X2)="0.15" mol·L-1 | B.c(Y2)="0.9" mol·L-1 |
| C.c(Z2)="0.3" mol·L-1 | D.c(Q2)="0.5" mol·L-1 |
下列变化规律不正确的是 ( )
| A.温度升高,水的电离平衡向右移动 |
| B.加水稀释时,醋酸钠的水解平衡向左移动 |
| C.增大压强,对醋酸的电离平衡影响不大 |
| D.向氯化铁溶液中加入氧化钠,水解平衡向右移动 |
对于可逆反应M+N Q 达到限度的标志是( )
Q 达到限度的标志是( )
| A.M、N、Q三种物质的浓度一定相等 | B.M、N全部变成了Q |
| C.M、N、Q三种物质的浓度不再变化 | D.反应已经停止 |
下列变化规律不正确的是 ( )
| A.温度升高,水的电离平衡向右移动 |
| B.加水稀释时,醋酸钠的水解平衡向左移动 |
| C.增大压强,对醋酸的电离平衡影响不大 |
| D.向氯化铁溶液中加入氧化钠,水解平衡向右移动 |
下列叙述正确的是
| A.可用于电动汽车的铝-空气燃料电池,通常用NaOH溶液做电解液,其正极反应为:O2+2H2O+4e-===4OH- |
| B.常温下,PH均为5的醋酸和硫酸铝两种溶液中,由水电离出的氢离子浓度均为1×10-9 mol·L-1 |
| C.溴化钠溶液中加入少量新制氯水充分反应后,再加入少量苯振荡静置后上层颜色变浅,下层颜色变为橙红色 |
| D.导电、缓慢氧化、品红褪色和久置浓硝酸变黄都一定属于化学变化 |
常温下,向20.00 mL 0.1000 mol·L—1 (NH4)2SO4溶液中逐滴加入0.2000 mol·L—1NaOH时,溶液的pH与所加NaOH溶液体积的关系如右下图所示(不考虑挥发)。下列说法正确的是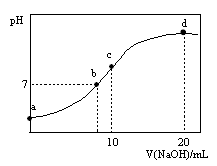
A.点a所示溶液中:c(NH )>c(SO )>c(SO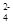 )>c(H+)>c(OH-) )>c(H+)>c(OH-) |
B.点b所示溶液中:c(NH )=c(Na+)>c(H+)=c(OH-) )=c(Na+)>c(H+)=c(OH-) |
C.点c所示溶液中:c(SO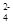 )+ c(H+)= c(NH3·H2O )+ c(OH-) )+ c(H+)= c(NH3·H2O )+ c(OH-) |
D.点d所示溶液中:c(SO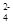 )>c(NH3·H2O )>c(OH-)>c(NH )>c(NH3·H2O )>c(OH-)>c(NH ) ) |
含SO2的烟气会形成酸雨,工业上常利用Na2SO3溶液作为吸收液脱除烟气中的SO2。随着SO2的吸收,吸收液的pH不断变化。下列粒子浓度关系一定正确的是:
A.Na2SO3溶液中存在: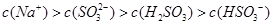 |
B.已知NaHSO3溶液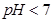 ,该溶液中: ,该溶液中: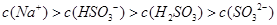 |
C.当吸收液呈中性时: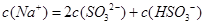 |
D.当吸收液呈酸性时: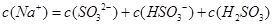 |
化学知识在生活中有重要意义,下列说法不正确的是
| A.草木灰(含有K2CO3)水溶液可以用于洗涤油污 |
| B.乙醇、乙酸和甲醛广泛应用于食品加工 |
| C.捕获排放的CO2能降低地球的温室效应 |
| D.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 |
试题篮
()