下列有关溶液中微粒浓度关系的叙述正确的是
| A.c(NH4+)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4) > c[(NH4)2SO4]> c(NH4Cl) |
| B.已知HF的酸性比CH3COOH强,pH相等的NaF与CH3COOK溶液中,[c(Na+)-c(F-)]< [c(K+)-c(CH3COO-)] |
| C.等物质的量浓度Na2CO3溶液和NaHCO3溶液等体积混合,所得溶液中:c(CO32-)+2c(OH-)=2c(H+)+c(HCO3-)+3c(H2CO3) |
| D.溶有等物质的量NaClO、NaHCO3的溶液中:c(HClO)+c(C1O-)=c(HCO3-)+c(H2CO3)+c(CO32-) |
经测定某溶液中只有Na+、CH3COO-、H+、OH-四种离子,且其浓度大小的排列顺序为:c (Na+)>c(CH3COO-)>c(OH-)>c(H+),下列有关说法正确的是
| A.该溶液由pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合而成 |
| B.该溶液由0.1 mol·L-1的CH3COOH溶液与0.1 mol·L-1的CH3COONa溶液等体积混合而成 |
| C.在上述溶液中加入适量CH3COOH,可能使溶液中离子浓度大小改变为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| D.在上述溶液中加入适量NaOH,可能使溶液中离子浓度大小改变为:c(CH3COO-)=c(Na+)>c(OH-)=c(H+) |
下列说法正确的是( )
| A.相同物质的量浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3·H2O; c(NH4+) 由大到小的顺序是:①>②>③>④ |
| B.某物质的溶液中由水电离出的c(H+)=1×10-a mol/L,若a>7时,则该溶液的pH一定为14-a |
| C.物质的量浓度相等的H2S和NaHS混合溶液中:c(Na+) +c(H+) =" c" (S2―) +c (HS―)+c (OH―) |
D.AgCl悬浊液中存在平衡: AgCl(s) 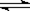 Ag+(aq)+Cl―(aq),往其中加入少量 NaCl粉末,平衡会向左移动,溶液中离子的总浓度会减小 Ag+(aq)+Cl―(aq),往其中加入少量 NaCl粉末,平衡会向左移动,溶液中离子的总浓度会减小 |
下列说法正确的是
| A.常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 |
| B.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。 若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
| C.用0.2000 mol/L NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均约为0.1 mol/L),至中性时,溶液中的酸未被完全中和 |
| D.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1mol/L盐酸、③0.1 mol/L氯化镁溶液、④0.1mol/L硝酸银溶液中,Ag+浓度:①>④=②>③ |
下列判断正确的是
A.同温下,HF比HClO易电离,则NaF溶液的pH比NaClO溶液的pH大
B.常温下,0.4 mol•L-1 HA溶液和0.2 mol•L-1NaOH溶液等体积混合后的pH等于3,则混合溶液中粒子浓度大小关系:c(A-)>c(Na+)>c(HA)>c(H+)>c(OH—)
C.常温下,BaSO4在饱和Na2SO4溶液中的Ksp比在纯水中的Ksp小
D.用铂电极电解食盐水,一段时间后两极产生气体体积比为3:2(同条件下),为将电解液恢复原状,则只需向电解液中通入一定量的HCl气体
对于常温下0.1mol·L-1 NaHCO3溶液,下列叙述不正确的是( )
| A.c (Na+)="c" (HCO3-) + c (CO32-) + c (H2CO3) |
| B.温度升高,溶液的pH升高,但溶液中的c(H+)与c(OH-)乘积不变 |
| C.与等体积等浓度的CH3COOH溶液反应后,溶液中c(Na+)>c(CH3COO-) |
| D.加入适量的NaOH固体,溶液的pH减小 |
下列叙述正确的是( )
| A.向体积为Va的0.02mol·L-1CH3COOH溶液中加入体积为Vb的0.02mol·L-1NaOH溶液,Va>Vb时:c (CH3COOH)+c(CH3COO-)>c (Na+) |
| B.将0.2 mol·L-1的盐酸与0.1 mol·L-1的KAlO2溶液等体积混合,其溶液中离子浓度由小到大的顺序为:c(OH-)<c(Al3+)<c(H+)<c(K+)<c(Cl-) |
| C.pH=5的HCOOH溶液和pH=5的NH4NO3溶液中,c(H+)不相等 |
| D.25℃时,pH=4,浓度均为0.1mol·L-1的CH3COOH、CH3COONa混合溶液: |
c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+)
常温下,0.1mol/L氨水溶液中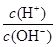 =1×10-8,下列叙述不正确的是
=1×10-8,下列叙述不正确的是
| A.该溶液中氢离子的浓度:c(H+)=1×10-11mol/L |
| B.0.1mol/L氨水溶液与0.1mol/L HCl溶液等体积混合后所得溶液中:c(NH+4)+c(H+)=c(Cl—)+c(OH+) |
| C.0.1mol/L的氨水溶液与0.05mol/L H2SO4溶液等体积混合后所得溶液中:c(NH+4)+c(NH3)+c(NH3·H2O)=2c(SO2—4) |
| D.浓度均为0.1mol/L的NH3·H2O和NH4Cl溶液等体积混合后,若溶液呈碱性,则c(NH4+)>c(NH3·H2O)>c(Cl-)>c(OH-)>c(H+) |
下列叙述正确的是
A.已知I3- I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫红色,说明KI3在CCl4中的溶解度比在水中的大 I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫红色,说明KI3在CCl4中的溶解度比在水中的大 |
B.室温下向10mL pH =3的醋酸溶液中加水稀释后,溶液中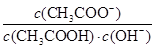 减小 减小 |
| C.室温时ka(HF)=3.6×10-4,ka(CH3COOH)=1.75×10-5,0.1 mol /L的NaF溶液与0.1 mol /L的CH3COOK溶液相比,一定有c(Na+) -c(F-)<c(K+)-c(CH3COO-)成立 |
D.在25℃时,将amol/L的氨水与0.01 mol/L的盐酸等体积混合,充分反应后溶液中c(NH4+)=c(Cl-),则25℃时NH3 • H2O的电离常数Kb=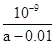 |
电导率可用于衡量电解质溶液导电能力的大小,且电导率越大溶液的导电能力越强。室温下 ,用0.l00 mol·L-1的NH3· H2O 滴定10 .00mL 浓度均为0 . 100 mol·L-1HCl和CH3COOH的混合液,电导率曲线如图所示。下列说法正确的是
| A.① 溶液中c(H +)为0 . 200 mol·L-1 |
| B.溶液温度高低为① >③ >② |
| C.③ 点后因离子数目减少使电导率略降低 |
| D.③ 点时溶液中有c ( C1一)>(CH3 COO一) |
(届江西省八校高三下学期联考理综化学试卷)
下列叙述或表示正确的是
| A.0.1 mol·L-1的醋酸的pH=a,0.01 mol·L-1的醋酸的pH=b,则a+1=b |
| B.常温下0.1 mol·L-1的醋酸溶液与等浓度等体积NaOH溶液反应后的溶液中:c(CH3COOH)+c(CH3COOˉ)="0.1" mol·L-1 |
| C.难溶电解质AB2的饱和溶液中,c(A2+)=xmol·L-1, c(B-)="y" mol·L-1,则Ksp值为4xy2 |
| D.用200mL4 mol·L-1的NaOH溶液将0.6mol CO2完全吸收,反应的离子方程式为:3CO2+4OHˉ=CO32ˉ+2HCO3ˉ+H2O |
下列说法正确的是( )
| A.室温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 |
| B.为确定某酸H2A是强酸还是弱酸,可测NAHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
| C.用0.200 0 mol·L-1 NAOH标准溶液滴定HCl与CH3COOH的混合液(混合液中两种酸的浓度均约为0.1 mol·L-1),至中性时,溶液中的酸未被完全中和 |
| D.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol·L-1盐酸、③0.1 mol·L-1氯化镁溶液、④0.1 mol·L-1硝酸银溶液中,Ag+浓度:①>④=②>③ |
下列关于电解质溶液中离子关系的说法正确的是
| A.0.1mol·L-1NaHCO3溶液中离子浓度关系:c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3) |
| B.0.1mol·L-1NH4Cl和0.1mol·L-1NH3·H2O等体积混合后离子浓度关系:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| C.常温下,向醋酸钠溶液中滴加少量醋酸使溶液的pH=7,则混合溶液中:c(Na+)=c(CH3COO-) |
| D.常温下,在pH=1的溶液中,Fe2+、NO3-、ClO-、Na+能大量共存 |
(届山东省日照市高三3月模拟考试理综化学试卷)
25oC时,取浓度均为0.1 mol·L-1的醋酸溶液和氨水溶液各20 mL,分别用0.1 mol·L-1NaOH溶液、0.1 mol·L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示。下列说法正确的是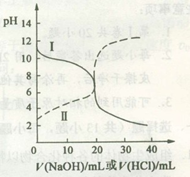
| A.曲线I中滴加溶液到10 mL时:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| B.曲线I中滴加溶液到25 mL时:c(NH4+)>c(C1-)>c(H+)>c(OH-) |
| C.曲线II中滴加溶液在10 mL~25 mL之间存在:c(NH4+)=c(Cl-)>c(OH-)=c(H+) |
| D.曲线II中滴加溶液到10mL时:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |
下列溶液或浊液中,关于离子浓度的说法正确的是
| A.一定浓度的氨水加水稀释的过程中,c(NH4+)/ c(NH3·H2O)的比值减小 |
| B.浓度均为0.1 mol·L-1的Na2CO3、NaHCO3混合溶液中:c(CO32-) > c(HCO3-),且2c(Na+)=3[c(CO32-)+c(HCO3-)] |
| C.0.2 mol·L-1的醋酸(CH3COOH)溶液与0.1 mol·L-1 NaOH溶液等体积混合后:c(CH3COO-) + 2c(OH-) = c(CH3COOH) + 2c(H+) |
| D.常温下,已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2Cr2O4)=2.0×10-12,则Ag2CrO4悬浊液中的c(Ag+)一定小于AgCl悬浊液中的c(Ag+) |
试题篮
()