(1)已知25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 |
HSCN |
CH3COOH |
HCN |
H2CO3 |
| 电离平衡常数 |
1.3×10—1 |
1.8×10—5 |
4.9×10—10 |
K1=4.3×10—7 K2=5.6×10—11 |
①等物质的量浓度的a.CH3COONa、b.NaCN、c.Na2CO3、d.NaHCO3溶液的pH由大到小的顺序为
(填序号)。
②25℃时,将20 mL 0.1 mol·L—1 CH3COOH溶液和20 mL 0.1 mol·L—1HSCN溶液分别与20 mL 0.1 mol·L—1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是 。反应结束后所得两溶液中,c(CH3COO—) c(SCN—)(填“>”、“<”或“=”)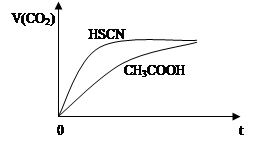
③若保持温度不变,在醋酸溶液中加入少量盐酸,下列量会变小的是______(填序号)。
a. c(CH3COO-) b. c(H+) c. Kw d. 醋酸电离平衡常数
(2)下图为某温度下,PbS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液的S2—浓度、金属阳离子浓度变化情况。如果向三种沉淀中加盐酸,最先溶解的是 (填化学式)。向新生成的ZnS浊液中滴入足量含相同浓度的Pb2+、Fe2+的溶液,振荡后,ZnS沉淀会转化为 (填化学式)沉淀。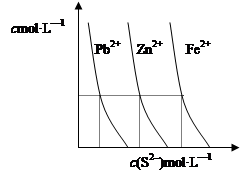
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解50 mL 2 mol·L—1的氯化铜溶液的装置示意图: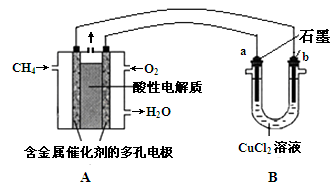
请回答:
① 甲烷燃料电池的负极反应式是 。
② 当线路中有0.1 mol电子通过时, 极增重________g
酸、碱、盐是化学工作者研究的重要领域,请回答下列各小题:(1)某二元酸H2X的电离方程式是:H2X=H++HX—,HX— X2—+H+。回答下列问题:
X2—+H+。回答下列问题:
①KHX溶液显 (填“酸性”、“碱性”或“中性”)。
②若0.1 mol·L—1KHX溶液的pH=2,则0.1 mol·L—1H2X溶液中氢离子的物质的量
浓度 (填“<”、“>”或“=”)0.11 mol·L—1,理由是 。
③0.01 mol·L—1的HCl与0.02 mol·L—1的KHX溶液等体积混合液中各离子浓度由大到小的顺序是  (2)在25℃下,向浓度均为0.1 mol·L—1的FeCl3和AlCl3混合溶液中逐滴加入氨水,先生成 (填化学式)沉淀。已知25℃时Ksp[Fe(OH)3]=2.6×10—39 mol4·L—4,KsP[Al(OH)3]=1.3×10—33 mol4·L—4。
(2)在25℃下,向浓度均为0.1 mol·L—1的FeCl3和AlCl3混合溶液中逐滴加入氨水,先生成 (填化学式)沉淀。已知25℃时Ksp[Fe(OH)3]=2.6×10—39 mol4·L—4,KsP[Al(OH)3]=1.3×10—33 mol4·L—4。
(3)在25℃下,有pH=3的醋酸溶液和pH=11的氢氧化钠溶液,其中氢氧化钠溶液的物质的量浓度是 ,醋酸溶液的物质的量浓度 (填“>”、“<”、“=”)氢氧化钠溶液物质的量浓度。将上述两溶液等体积混合,反应后溶液显 (填“酸”、“碱”、“中”)性。
(4)某强酸性反应体系中,发生反应:
X+ PbO2+ H2SO4 = Pb(MnO4)2+ PbSO4+ H2O ,
已知X是一种硫酸盐,且0.2 mol X在该反应中失去1 mol 电子,则X的化学式是
。请将上述化学方程式配平,把系数填在各物质前的横线上。.
某盐酸的密度为1.095g·cm-3,质量分数为10.0%,试计算:
(1)该盐酸的物质的量浓度是多少?
(2)200mL该盐酸跟足量的锌粒充分反应,生成气体的体积(标准状况下)是多少L?
Ⅰ:(4分)若取4.00mol/L的氨水30.0mL与70.0mL2.00mol·L-1的AlCl3溶液相混合,产生白色沉淀的质量是 g
Ⅱ:实验室用4.35gMn02与l00 mL11mol/L的浓盐酸(足量)反应制取氯气。 试计算:
(1)在标准状况下,生成氯气的体积。(不考虑氯气在溶液中的溶解)
(2)将反应后的溶液加水稀释到500mL,向从其中取出的50mL溶液中加入足量AgN03溶液,生成沉淀的物质的量。(要求写出计算过程)
向100ml0.1 mol·L-1的Al2(SO4)3溶液中,加入0.5mol·L-1的氢氧化钠溶液得到1.17克沉淀,则需加入的氢氧化钠溶液的体积是多少?(强调要有解题过程)
将Cu与CuO的混合物20.8g加入到50mL 18.4mol/L浓H2SO4中,加热充分反应至固体物质完全溶解,冷却后将混合液稀释至1000 mL,测得c(Cu2+)="0.3" mol/L。试计算:
(1)反应过程中放出的气体在标准状况下的体积(不考虑气体在溶液中的溶解)。
(2)溶液稀释后,c(H+)是多少?
维生素C(分子式为C6H8O6)具有较强的还原性,放置在空气中易被氧化,其含量可通过在弱酸性溶液中用已知溶液的I2溶液进行滴定。该反应的化学方程式如下:
C6H8O6+I2 C6H6O6+2HI
C6H6O6+2HI
现欲测定某样品中维生素C的含量,具体的步骤及测得的数据如下。取10mL 6mol·L-1CH3COOH,加入100mL蒸馏水,将溶液加热煮沸后放置冷却。精确称取0.2000g样品,溶解于上述冷却的溶液中,加入1mL淀粉指示剂,立即用浓度为0.05000mol·L-1的I2溶液进行滴定,直至溶液中的蓝色持续不褪为止,共消耗21.00mLI2溶液。
(1)为何加入的CH3COOH稀溶液要先经煮沸、冷却后才能使用?
(2)计算样品中维生素C的质量分数。
向50mL1mol/L的Al2(SO4)3溶液中加入100mLKOH溶液,充分反应得到3.9g沉淀,求KOH溶液的物质的量浓度。(原子量Al27 O16 S32 K39 H1 )
Al2(SO4)3+ 6KOH="2" Al(OH)3↓+3K2 SO4
某固态混合物中含有mgKNO3和若干不溶于水的杂质,将此混合物加入ng水中,在10℃、40℃、75℃时观察,充分溶解后的结果如下(溶解度曲线如图所示):
| 温度 |
10℃ |
40℃ |
75℃ |
| 未溶固体 |
261 g |
175 g |
82 g |
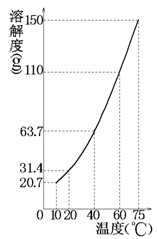
通过计算回答:
(1)m、n的值各为多少?
(2)75℃时所得溶液是否饱和?
(3)在什么温度将mg硝酸钾溶于ng水中恰好达到饱和状态?
(1)a值可否等于3(填“可”或“否”)_______,其理由是__________________。
(2)a值可否等于5(填“可”或“否”)_______,其理由是__________________。
(3)a的取值范围是_____________。
(Ⅰ)常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
| 实验编号 |
HA的物质的量 浓度(mol·L-1) |
NaOH的物质的量 浓度(mol·L-1) |
混合后 溶液的pH |
| 甲 |
0.1 |
0.1 |
pH=a |
| 乙 |
0.12 |
0.1 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
0.1 |
0.1 |
pH=10 |
(1)从甲组情况分析,如何判断HA是强酸还是弱酸? ▲ 。
(2)乙组混合溶液中离子浓度c(A—)和c(Na+)的大小关系是 ▲ 。
A.前者大 B. 后者大 C. 二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是 ▲ 。
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):
c(Na+)—c(A-)= ▲ mol·L-1
(Ⅱ)某二元酸(化学式用H2B表示)在水中的电离方程式是:
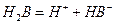

回答下列问题:
(5)在0.1mol/L的Na2B溶液中,下列粒子浓度关系式正确的是 ▲ 。
A.c( B2—)+c(HB—)=0.1mol/L B.c( B2—)+ c(HB—)+c(H2B)=0.1mol/L
C c(OH—)=c(H+)+ c(HB—) D.c(Na+)+c(OH)=c(H+)+ c(HB—)
(9分) 已知有关物质的氧化性强弱顺序为:浓硫酸>Fe3+>H+>Fe2+。称得 60 g 铁粉与100 mL 浓硫酸在加热的条件下反应,反应最终有固体剩余,共收集到标准状况下气体22.4 L,气体的质量为39.2 g。试回答以下问题:(又知:2Fe 3++ Fe = 3Fe2+)
(1)在加热的条件下开始反应到最终有固体剩余,还涉及到的化学方程式有:
_______________________________________________________________________;
(2)求浓硫酸的物质的量浓度;
(3)反应最终剩余固体的质量。(写出简单的计算过程)
试题篮
()