升高温度,下列常数中不一定增大的是
| A.平衡常数K | B.电离常数Ka |
| C.水的离子积常数Kw | D.盐的水解常数Kh |
下列各物质溶液中,指定微粒浓度之间的关系不正确的是( )
| A.饱和NH4Cl溶液中:c(H+)+ c(NH4+)= c(Cl―)+ c(OH―) |
| B.0.1mol/LNaHCO3溶液中:c(HCO3―)+ c(CO32―)+ c(H2CO3)=0.1mol/L |
| C.饱和NaHS溶液中:c(Na+)> c(HS―)> c(H+)> c(OH―) |
| D.0.1mol/LCH3COONa溶液中:c(CH3COO―)> c(OH―) |
下列叙述正确的是( )
| A.含1 mol溶质的任何溶液,物质的量浓度一定相等 |
| B.配制1 mol·L-1 NaCl溶液1 L,其方法是:将58.5 g NaCl溶于1 L水中即可 |
| C.体积相同、物质的量浓度相同的同种溶液所含溶质的粒子数一定相同 |
| D.1 L 0.5 mol·L-1 CaCl2溶液中,Ca2+与Cl-的物质的量浓度都是0.5 mol·L-1 |
在四个不同的容器中进行合成氨的反应。根据下列在相同时间内测定的结果,判断生成氨的速率最快的是
| A.v (N2)=0.05mol·L-1·s-1 | B.v (H2)=0.3mol·L-1·min-1 |
| C.v (N2)="0.2" mol·L-1·min-1 | D.v (NH3)="0.3" mol·L-1·min-1 |
有100 mL 3 mol·L-1的氢氧化钠溶液和100 mL 1 mol·L-1的氯化铝溶液。按如下两种方法进行实验:
①将氢氧化钠溶液分多次加入到氯化铝溶液中;
②将氯化铝溶液分多次加入到氢氧化钠溶液中。
比较两次实验,结果是( )
| A.现象相同,最终沉淀量相等 | B.现象不同,最终沉淀量不相等 |
| C.现象相同,最终沉淀量不相等 | D.现象不同,最终沉淀量相等 |
下列图示与对应的叙述相符的是 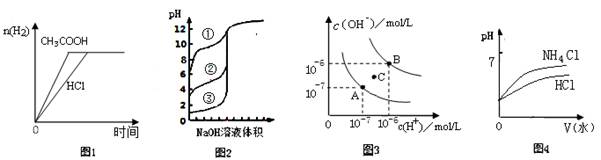
| A.图1中曲线表示向等体积、等物质的量浓度的盐酸和醋酸溶液中,分别加入足量镁粉,产生H2的物质的量的变化 |
| B.图2表示用0.1000mol/LNaOH溶液分别滴定浓度相同的三种一元酸,由曲线可确定③的酸性最强 |
| C.图3为水的电离平衡曲线图,若从A点到C点,可采用在水中加入适量NaOH固体的方法 |
| D.图4表示将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数时,二者 pH的变化 |
在HNO3、Al(NO3)3和Mg(NO3)2的混合溶液中逐滴加入NaOH溶液,则消耗NaOH溶液的体积(x轴)与生成沉淀(y轴)之间的关系表示正确的是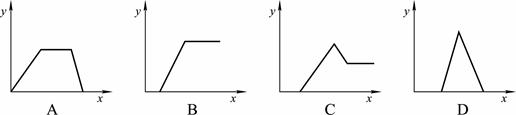
下列变化规律不正确的是 ( )
| A.温度升高,水的电离平衡向右移动 |
| B.加水稀释时,醋酸钠的水解平衡向左移动 |
| C.增大压强,对醋酸的电离平衡影响不大 |
| D.向氯化铁溶液中加入氧化钠,水解平衡向右移动 |
关于2molCO2的叙述,正确的是 (相对原子质量 C—12 O—16)
| A.质量为88g | B.摩尔质量为88g/mol |
| C.分子数为1.204×1024个 | D.常温下,体积为44.8L |
下列溶液中,Na+ 浓度最大的是( )
| A.1mol/L Na2SO4溶液200mL | B.0.9mol/L Na3PO4溶液200mL |
| C.2.5mol/L NaOH 溶液100mL | D.1mol/L NaHCO3溶液300mL |
某盐的混合物中含有0.2 mol Na+、0.4 mol Mg2+、0.4 mol Cl -,则SO42- 为( )
| A.0.1 mol | B.0.3 mol | C.0.5 mol | D.0.15 mol |
对于可逆反应M+N Q 达到限度的标志是( )
Q 达到限度的标志是( )
| A.M、N、Q三种物质的浓度一定相等 | B.M、N全部变成了Q |
| C.M、N、Q三种物质的浓度不再变化 | D.反应已经停止 |
化学知识在生活中有重要意义,下列说法不正确的是
| A.草木灰(含有K2CO3)水溶液可以用于洗涤油污 |
| B.乙醇、乙酸和甲醛广泛应用于食品加工 |
| C.捕获排放的CO2能降低地球的温室效应 |
| D.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 |
试题篮
()