(1)某温度下,纯水中c(H+) = 5×10-7 mol·L-1,则此时纯水中的c(OH-) =" ____" mol·L-1;若温度不变,滴入稀硫酸使c(H+) = 5.0×10-3 mol·L-1,则c(OH-) =" ____" mol·L-1。
(2)已知室温下pH=2的高碘酸(H5IO6)溶液与pH=12的NaOH溶液等体积混合,所得混合溶液呈酸性,则高碘酸的电离方程式是__________________________。
请认真运算,并将正确答案填写在空白处。(不得使用计算器)
(1)恒温下,向pH = 6的蒸馏水中加入2.3 g金属钠充分反应后,再加蒸馏水稀释至1L,所得溶液的pH =
(2)常温下,pH = 5的稀H2SO4溶液稀释1000倍,则稀释后溶液中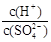 的比值为
的比值为
(3)25℃,在等体积的①pH=0的H2SO4溶液②0.05 mol/L的Ba(OH)2溶液③pH=10的K2S溶液④pH=5的NH4NO3溶液中发生电离的水的物质的量之比为
(4)当NH3·H2O和盐酸混合恰好中和成c mol/L的NH4Cl稀溶液,试用c、c(H+)及氨水的Kb值、水的Kw值表示该溶液中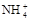 的平衡浓度,c(
的平衡浓度,c(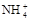 )平=
)平=
根据下列事实,完成相关的离子方程式或电离方程式
(1)Na2S溶液使酚酞显红色
(2)硫酸铝钾[明矾KAl(SO4)2·12H2O]可以作净水剂
(3)常温下,磷酸(H3PO4)溶液pH﹤7
(4)将饱和氯化铵溶液加入到硅酸钠溶液中很快生成白色胶状沉淀,并产生刺激性气味的气体
已知H2A在水中存在以下平衡:H2A H++HA-,HA
H++HA-,HA H++A2-。回答以下问题:
H++A2-。回答以下问题:
(1)NaHA溶液________(填“显酸性”、“显碱性”、“显中性”或“酸碱性无法确定”),原因是_____________________________ ___。
(2)某温度下,向0.1 mol·L-1的NaHA溶液中滴入0.1 mol·L-1KOH溶液至中性,此时溶液中以下关系一定正确的是________(填字母)。
A.c(H+)·c(OH-)=1×10-14 mol2·L-2 B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+) D.c (Na+)+c(K+)=0.05 mol·L-1
(3)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:CaA(s)  Ca2+(aq)+A2-(aq);ΔH>0。
Ca2+(aq)+A2-(aq);ΔH>0。
①温度升高时,Ksp________(填“增大”、“减小”或“不变”,下同)。
②滴加少量浓盐酸,c(Ca2+)________,原因是
__________________________________________(用文字和离子方程式说明)。
(4)若向CaA悬浊液中加入CuSO4溶液,生成一种黑色固体物质,写出该过程中反应的离子方程式___________________________________________
、根据电离平衡移动原理完成下列表格
(1)已知:CH3COOH为弱电解质,在醋酸溶液中,当改变条件后,完成表格中的变化情况
| 外加条件 |
平衡移动方向 |
C(OH -) |
C(CH3COO -) |
| 升温 |
|
不填 |
不填 |
| 加水 |
|
|
不填 |
| 加盐酸 |
不填 |
|
|
| 加少量氢氧化钠固体 |
不填 |
不填 |
|
(2)在一定温度下,冰醋酸加水稀释过中溶液的导电能力如下图所示,请回答: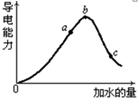
①写出醋酸的电离方程式________________。
②a、b、c三点溶液中氢离子浓度由小到大的顺序为__________________ 。
③a、b、c三点中醋酸的电离程度最大的是 。
④取甲、乙两份等体积c点的溶液,甲用蒸馏水稀释10倍,,乙用蒸馏水稀释100倍,则稀释后甲、乙两溶液中的H+浓度:C(H+)甲_____ 10C(H+)乙(填“大于”、“小于”或 “等于”),
下表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp (25℃)。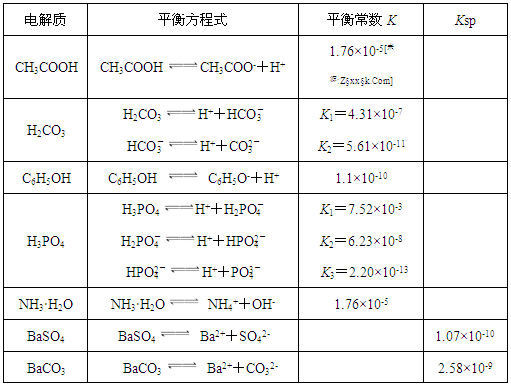
回答下列问题:
(1)由上表分析,若①CH3COOH ②HCO3- ③C6H5OH ④H2PO4-均可看作酸,则它们酸性由强到弱的顺序为 (须填编号);
(2)写出C6H5OH与Na3PO4反应的离子方程式: ;
(3)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中:c(CH3COO-)
c(NH4+);(填“>”、“=”或“<”)
(4)25℃时,向10ml 0.01mol/L苯酚溶液中滴加Vml 0.01mol/L氨水,混合溶液中粒子浓度关系正确的是 ;
A.若混合液pH>7,则V≥10
B.若混合液pH<7,则c((NH4+) >c (C6H5O-) >c (H+)>c (OH-)
C.V=10时,混合液中水的电离程度小于10ml 0.01mol/L苯酚溶液中水的电离程度
D.V=5时,2c(NH3·H2O)+ 2 c (NH4+)= c (C6H5O-)+ c (C6H5OH)
(5)水解反应是典型的可逆反应.水解反应的化学平衡常数称为水解常数(用Kh表示),类比化学平衡常数的定义,请写出Na2CO3第一步水解反应的水解常数的表达式 。
(6)Ⅰ.如下图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题: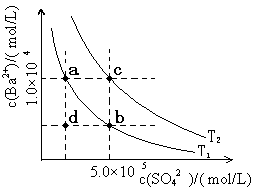
① T1 T2(填>、=、<),
T2温度时Ksp(BaSO4)= ;
②讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法正确的是
A.加入Na2SO4可使溶液由a点变为b点
B.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
D.升温可使溶液由b点变为d点
Ⅱ.现有0.2mol的BaSO4沉淀,每次用1L饱和Na2CO3溶液(浓度为 1.7mol/L)处理。若使BaSO4中的SO42-全部转化到溶液中,需要反复处理 次。[提示: BaSO4(s)+ CO32- (aq)
1.7mol/L)处理。若使BaSO4中的SO42-全部转化到溶液中,需要反复处理 次。[提示: BaSO4(s)+ CO32- (aq) BaCO3(s)+ SO42- (aq) ]
BaCO3(s)+ SO42- (aq) ]
分析、归纳、探究是学习化学的重要方法和手段之一.下面就电解质A回答有关问题(假定以下都是室温时的溶液).
(1)电解质A的化学式为NanB,测得浓度为c mol/L的A溶液的pH=a.
①试说明HnB的酸性强弱_______________________________________.
②当a=10时,A溶液呈碱性的原因是(用离子方式程式表示)________________.
③当a=10、n=1时,A溶液中各种离子浓度由大到小的顺序为
_______________________________________________________.
c(OH-)-c(HB)=________.
④当n=1、c=0.1、溶液中c(HB)∶c(B-)=1∶99时,A溶液的pH为__________(保留整数值).
(2)已知难溶电解质A的化学式为XnYm,相对分子质量为M,测得其饱和溶液的密度为ρ g/cm3,Xm+离子的浓度为c mol/L,则该难溶物XnYm的溶度积常数为Ksp=__________________________,该温度下XnYm的溶解度S=____________.
(1)下列溶液中,c(H+)由小到大的排列顺序是
①0.1mol/L HCl溶液 ②0.1mol/L H2SO4溶液
③0.1mol/L NaOH溶液 ④0.1mol/L CH3COOH溶液
(2)25℃,柠檬水的pH是3,其中c(OH?)= 。
(3)25 ℃,有pH=12的氢氧化钠溶液100ml,要使它的pH降为11。应加蒸馏水的体积为 ml;若加pH=10的氢氧化钠溶液,应加 ml。
(4)25 ℃,pH=3盐酸和pH=11氨水等体积混合后溶液呈 性。(选填“酸”、“中”或“碱”)
(1)25℃,柠檬水的pH是3,其中c(OH-)==
(2)下列溶液中,c(H+)由小到大的排列顺序是
① 0.1mol/L HCl 溶液 ② 0.1mol/L H2SO4溶液
③ 0.1mol/L NaOH溶液 ④0.1mol/L CH3COOH溶液
(3)在25℃时,1mol· L-1的①(NH4)2SO4 ②CH3COONH4 ③(NH4)2Fe(SO4)2 ④NH4Cl的溶液中,c(NH4+)由大到小的顺序为
(4)pH=3盐酸和pH=11氨水等体积混合后溶液呈 性(选填“酸”、“中”或“碱”),溶液中c(NH4+) c(Cl-)(选填“ >”“=”“<” )。
(4分)已知25 ℃时,0.1 mol/L醋酸溶液的pH约为3,向其中加入少量醋酸钠晶体,待晶体溶解后发现溶液的pH增大,对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,增大了c(OH-),因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大。
(1)为了验证上述哪种解释正确,继续做如下实验:向0.1 mol/L的醋酸溶液中加入少量下列物质中的____________(填写编号),然后测定溶液的pH。
| A.固体CH3COOK | B.固体CH3COONH4 | C.气体NH3 | D.固体NaHCO3 |
(2)若乙的解释正确,溶液的pH应__________(填“增大”“减小”或“不变”)。(已知25 ℃时,NH3·H2O的Kb=1.8×10-5,CH3COOH的Ka=1.8×10-5)
(1)25℃,柠檬水的pH是3,其中c(OH-)==
(2)下列溶液中,c(H+)由小到大的排列顺序是
① 0.1mol/L HCl 溶液 ② 0.1mol/L H2SO4溶液
③ 0.1mol/L NaOH溶液 ④0.1mol/L CH3COOH溶液
(3)在25℃时,1mol· L-1的①(NH4)2SO4 ②CH3COONH4 ③(NH4)2Fe(SO4)2 ④NH4Cl⑤(NH4)2CO3的溶液中,c(NH4+)由大到小的顺序为
(4)pH=3盐酸和pH=11氨水等体积混合后溶液呈 性(选填“酸”、“中”或“碱”),溶液中
c(NH4+) c(Cl-)(选填“ >”“=”“<” )。
工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种:还原沉淀法和电解法。还原沉淀法的工艺流程为:其中第①步存在平衡:2CrO42—(黄色)+2H+ Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O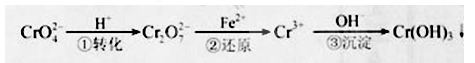
(1)若平衡体系的pH=2,则溶液显 色.
(2)能说明第①步反应达平衡状态的是 。
a.Cr2O72—和CrO42—的浓度相同 b.2v (Cr2O72—) ="v" (CrO42—) c.溶液的颜色不变
(3)第②步中,还原1mol Cr2O72—离子,需要________mol的FeSO4·7H2O。
( 4 ) 第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s) Cr3+(aq)+3OH—(aq)
Cr3+(aq)+3OH—(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH—)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至 。
(1)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为(填序号) 。
A.9 B.13 C.11~13之间 D.9~11之间
(2)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号) 。
A.氨水与氯化铵发生化学反应
B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH―)减小
(3)25℃时,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失),① 和 两种粒子的物质的量之和等于0.1mol。 (4)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
(4)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
①若溶液中只溶解了一种溶质,该溶质的名称是 ,上述离子浓度大小顺序关系中正确的是(选填序号) 。
②若上述关系中C是正确的,则溶液中溶质的化学式是 。
③若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前 c (HCl)(填“>”、“<”、或“=”,下同) c(NH3·H2O).
混合后溶液中与c(NH4+) c(Cl-)。
(12分)A、B代表不同物质,都是H、N、O、Na中的任意三种元素组成的强电解质,A的水溶液呈碱性,B的水溶液呈酸性,请找出A、B可能的两种组合。要求:相同浓度时,A1溶液中水的电离程度小于A2溶液中水的电离程度;相同浓度时,B1溶液中水的电离程度小于B2溶液中水的电离程度。
(1)写出化学式A1________,A2________,B1________,B2________;
(2)相同温度下,当A1、B1的物质的量浓度相等时,两溶液中水电离出的氢离子的物质的量浓度之比为_______________________ _;
(3)写出0.1 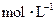 的
的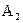 溶液中离子浓度大小排序 ________________;
溶液中离子浓度大小排序 ________________;
(4)B1溶液中水的电离程度小于B2溶液中水的电离程度,原因是 ________________;
(5)若B1、B2两溶液的pH=5,则两溶液中水电离出的氢离子的物质的量浓度之比为
试题篮
()