在如下图所示的装置中,a的金属性比氢要强,b为碳棒,关于此装置的各种叙述不正确的是( )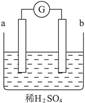
| A.碳棒上有气体放出,pH变大 |
| B.a是正极,b是负极 |
| C.导线中有电子流动,电子从a极到b极 |
| D.a极上发生了氧化反应 |
由反应物粒子一步直接实现的化学反应称为基元反应。某化学反应是通过三步基元反应实现的:
①Ce4++Mn2+→Ce3++Mn2+
②Ce4++Mn3+→Ce3++Mn4+
③Ti4++Mn4+→Ti3++Mn2+
由此可知,该反应的催化剂是( )
| A.Ce4+ | B.Ti3+ | C.Mn3+ | D.Mn2+ |
在Na2S溶液中存在的下列关系不正确的是( )
| A.c(Na+)=2c(S2-)+2c(HS-)+2c(H2S) |
| B.c(Na+)+c(H+)=c(OH-)+c(HS-)+c(S2-) |
| C.c(OH-)=c(H+)+c(HS-)+2c(H2S) |
| D.c(Na+)>c(S2-)>c(OH-)>c(HS-) |
能正确表示下列反应的离子方程式的是( )
| A.甲酸钠溶液和盐酸反应 HCOO-+H+====HCOOH |
B.硫化钠第一步水解S2-+2H2O H2S+2OH- H2S+2OH- |
C.醋酸钡溶液和硫酸反应Ba2++SO ====BaSO4↓ ====BaSO4↓ |
D.氢氧化钙溶液和碳酸氢镁反应Ca2++OH-+HCO ====CaCO3↓+H2O ====CaCO3↓+H2O |
用标准盐酸溶液滴定未知浓度的氢氧化钠溶液,如果测得结果偏低,则产生误差的原因可能是下列叙述中的( )
| A.锥形瓶用蒸馏水洗净后,未经干燥即进行滴定 |
| B.滴定前酸式滴定管尖嘴部分有气泡,滴定终止时气泡消失 |
| C.酸式滴定管未用标准盐酸溶液润洗 |
| D.把氢氧化钠待测液移入锥形瓶中时,有少量碱液溅出 |
下列各组离子在溶液中能大量共存的是……()
| A.Na+、HS-、Cu2+、Cl- |
| B.HS-、Na+、OH-、K+ |
| C.K+、CO32-、Br-、AlO2- |
| D.H+、Cl-、Na+、SO32- |
NaHSO4是一种酸式盐。
(1)NaHSO4晶体熔化时的电离方程式为 。
(2)0.1mol·L-1的NaHSO4溶液的pH= 。
(3)NaHSO4溶液与NaHCO3溶液反应的离子方程式为 。
(4)2mol·L-1NaHSO4与1mol·L-1Ba(OH)2溶液等体积混合,反应的离子方程式为______________。若在反应的溶液中继续滴加Ba(OH)2溶液,反应的离子方程式为 。
pH=1的两种酸溶液A、B各1 mL,分别加水稀释到1000mL,其pH值与溶液体积的关系如图,下列说法正确的是 ( )
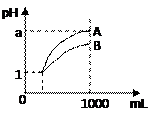 |
A.A、B两种酸溶液的物质的量浓度一定相等
B.稀释后,A酸溶液的酸性比B酸溶液强
C.若1< a < 4,则A、B都是弱酸
D.若a = 4,则A是弱酸,B是强酸。
酸碱指示剂一般是有机弱酸(用Hln表示)或弱碱,其分子形式与电离出的ln—形式颜色不同,在pH值不同的溶液中至所以能表现出不同的颜色,是因为其电离平衡发生移动的结果。甲基橙是一种常用的酸碱指示剂,溶于水后发生如下电离:Hln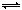 H++ln—,已知在pH<3.1的溶液中呈红色,在pH>4.4的溶液中呈黄色,下列判断中不正确的是 ( )
H++ln—,已知在pH<3.1的溶液中呈红色,在pH>4.4的溶液中呈黄色,下列判断中不正确的是 ( )
| A.Hln呈红色 |
B.ln—呈黄色 |
| C.遇pH值介于3.1~4.4的溶液可能呈橙色 |
| D.Hln呈黄色 |
常温下,向一定浓度的氨水中逐滴加入盐酸,关于溶液中各离子浓度大小关系叙述最准确的是 ( )
| A.c(Cl—)> c(NH4+) > c(H+) > c(OH—) |
| B.c c(NH4+) = c(Cl—) > c(H+) = c(OH—) |
| C.c(NH4+) > c(Cl—) > c(OH—) > c(H+) |
| D.以上说法都有可能 |
如果直接蒸干某些盐的溶液,则无法得到相应的盐晶体,在空气中直接蒸发下列盐的溶液时:①Al2(SO4)3、②Na2CO3③KCl ④CuCl2 ⑤NaHCO3,可以得到相应盐晶体(可以含有结晶水)的是 ( )
| A.①③⑤ | B.①②③ | C.②④ | D.①③④⑤ |
试题篮
()