将物质的量浓度为Xmol/L的稀盐酸与物质的量浓度为Ymol/L的稀NaOH溶液等体积混合,所得溶液的pH=2(混合后体积为混合前之和),则X和Y的关系是( )
| A.X=Y+0.0l | B.X="2Y" | C.Y="2X" | D.X=Y+0.02 |
下面的是某同学实验报告中记录的一些内容:①用量筒量值25.00mLNaOH 溶液②用碱式滴定管量取20.00mL KMnO4溶液③用pH试试测得氨水pH=10.2 ④向Na2CO3溶液加入足量BaCl2溶液后,溶液的pH="7" ⑤用托盘天平称量所得沉淀质量为5.21g,其中不正确的是 ( )
| A.①②③④⑤ | B.①②③⑤ | C.②③④ | D.④⑤ |
一种矿泉水标签上印有主要矿物成份(单位:mg.L-1):Ca:60.00、K:39.00、Mg:3.100、Zn:0.08、F:0.02等,则对此矿泉水的叙述正确的是 ( )
①该矿泉水不导电
②该矿泉水导电
③该矿泉水是电解质
④该矿泉水是非电解质
| A.②③ | B.② | C.②④ | D.①④ |
莫尔盐[(NH4)2Fe(SO4)2·6H2O]常作氧化还原滴定法的基准物质,在0.1mol/L的该盐的溶液中,下列有关比较不正确的是( )
A.c(SO )> c(NH )> c(NH )>c(Fe2+)>c(H+)>c(OH-) )>c(Fe2+)>c(H+)>c(OH-) |
B.c(NH3·H2O)+c(NH )= 0.2mol/L )= 0.2mol/L |
| C.c(H+)= c(OH-)+c(NH3·H2O) |
D.2 c(SO )+ c(OH-)= c(NH )+ c(OH-)= c(NH )+2 c(Fe2+)+c(H+) )+2 c(Fe2+)+c(H+) |
下列有关滴定操作的顺序正确的是 ( )
①用标准溶液润洗滴定管 ②往滴定管中注入标准溶液
③检查滴定管是否漏水 ④滴定 ⑤洗涤
| A.⑤①②③④ | B.③⑤①②④ | C.⑤②③①④ | D.②①③⑤④ |
常温时,某溶液中由水电离出的H+和OH-的物质的量浓度乘职为1×10-26,该溶液中一定能大量存在的离子组是 ( )
| A.K+、Ba2+、Cl-、NO3- |
| B.Fe3+、Cu2+、Cl-、HCO3- |
| C.K+、Na+、SO32-、SO42- |
| D.Ca2+、Al3+、H+、NO3- |
将0.l mol·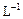 醋酸溶液加水稀释,下列说法正确的是 ( )
醋酸溶液加水稀释,下列说法正确的是 ( )
| A.溶液中各离子浓度均减小 |
| B.溶液中c(H+)增大 |
| C.醋酸电离平衡向左移动 |
| D.溶液的pH增大 |
将0.1.mol/L的下列物质的水溶液,从常温加热到80℃(不计水的蒸发),溶液的pH不变的是( )
| A.NaCl | B.(NH4)2SO4 | C.H2SO4 | D.Ba(OH)2 |
欲鉴别物质的量浓度都为0.1mol·L-1的KCl、(NH4)2SO4、NH3·H2O和H2SO4四瓶无色溶液,下列实验方案最佳的是 ( )
| A.用pH试纸鉴别 |
| B.分别用闻气味和pH试纸鉴别 |
| C.分别用BaCl2和NaOH溶液鉴别 |
| D.用Ba(OH)2溶液鉴别 |
下列反应完成后没有沉淀的是
| A.BaCl2溶液与Na2CO3溶液加足量稀CH3COOH |
| B.Ba(OH)2溶液与KNO3溶液加足量稀H2SO4 |
| C.AgNO3溶液与Na2CO3溶液加足量稀HCl |
| D.AgNO3溶液与FeCl3溶液加足量稀HNO3 |
已知25℃时,AgI和AgCl饱和溶液中c(Ag+)分别为1.22×10-8mol·L-1和1.30×10-5mol·L-1。若在5mL含有KCl和KI浓度均为0.01mol·L-1的混合溶液中,滴加等体积等物质的量的浓度的AgNO3溶液。下列叙述不正确的是( )
| A.溶液中先产生的是AgI沉淀 |
| B.AgCl的Ksp为1.69×10-10 |
| C.混合溶液中所含溶质的离子浓度大小关系为:c(K+)>c(NO3-)>c(Ag+)>c(Cl-)>c(I-) |
| D.若在AgI悬浊液中滴加少量的KCl溶液,黄色溶液不会转变成白色沉淀 |
下列各组物质反应中,溶液的导电性比反应前明显增强的是( )
| A.向亚硫酸钠溶液中加液溴 |
| B.向硝酸银溶液中通入少量氯化氢 |
| C.向氢氧化钠溶液中通入少量氯气 |
| D.向硫化氢饱和溶液中通入少量氯气 |
下列有关叙述正确的是( )
| A.强电解质的饱和溶液一定是浓溶液 |
| B.凡是能导电的物质都是电解质 |
| C.氯气不是电解质,所以氯水不导电 |
| D.硫酸是强电解质 |
欲使醋酸溶液中的CH3COO-浓度增大,且不放出气体,可加入的少量固体是( )
| A.NaOH | B.碳酸氢钠 | C.醋酸钾 | D.镁 |
试题篮
()