已知Q与R的摩尔质量之比为9:22,在反应X+2Y=2Q+R中,当1.6 g X和Y完全反应后生成4.4 g R,则参与反应的Y和生成物Q的质量之比为( )
| A.46:9 | B.32:9 | C.23:9 | D.16:9 |
某硝酸铵样品中混有另一种氮肥,经测定该样品中含氮38%,则该样品中可能混有的氮肥是( )。
| A.NH4HCO3 | B.(NH4)2SO4 | C.NH4Cl | D.CO(NH2)2 |
现有质量分数为15%的食盐溶液20 g,质量分数为40%的食盐溶液15 g,另有足够多的食盐固体和水,要配制质量分数为20%的食盐溶液30 g。
(1)试选择多种可能的配制方法(至少四种)。
(2)若要求尽可能多地使用现有的食盐水,应如何配制?
“氢能”被视为21世纪最具发展潜力的清洁能源。氢气的燃烧效率非常高,只要在汽油中加入4%的氢气,就可使内燃机节油40%。目前,氢能技术在美国、日本、欧盟等国家和地区已进入系统实施阶段。氢气的制取与储存是氢能源利用领域的研究热点。
已知:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=206.2 kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=247.4 kJ·mol-1
2H2S(g)=2H2(g)+S2(g) ΔH=169.8 kJ·mol-1
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。
CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为________。
(2)H2S热分解制氢气时,常向反应器中通入一定比例空气,使部分H2S燃烧,其目的是____________;燃烧生成的SO2与H2S进一步反应,生成物在常温下均为非气体,写出该反应的化学方程式:________________。
(3)H2O的热分解也可得到H2,高温下水分解体系中主要气体的体积分数与温度的关系如图1所示。图中A、B表示的物质依次是________。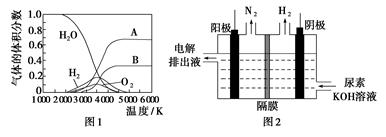
(4)电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图见图2(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极的电极反应式为________________。
(5)Mg2Cu是一种储氢合金。350 ℃时,Mg2Cu与H2反应,生成MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数为0.077)。Mg2Cu与H2反应的化学方程式为____________。
常温下,向20 L的真空容器中通入a mol H2S和b mol SO2(a和b都是正整数,且a≤5,b≤5)。反应完全后,容器内气体可能达到的最大密度是( )
| A.24.5 g/L | B.14.4 g/L | C.8 g/L | D.5.19 g/L |
一定体积的KMnO4溶液恰好能氧化一定质量的KHC2O4·H2C2O4·2H2O。若用0.1000
mol/L的NaOH溶液中和相同质量的KHC2O4·H2C2O4·2H2O,所需NaOH溶液的体积恰好为KMnO4溶液的3倍,则KMnO4溶液的浓度(mol/L)为(提示:①H2C2O4是二元弱酸;②10[KHC2O4·H2C2O4]+8KMnO4+17H2SO4=8MnSO4+9K2SO4+40CO2↑+32H2O)
| A.0.008889 | B.0.0800 | C.0.1200 | D.0.2400 |
自然界中存在一种尖晶石,化学式为MgAl2O4,它透明色美,可作为宝石。已知该尖晶
石中混有Fe2O3,取一定量样品5.4 g,恰好与一定浓度100 mL盐酸反应,盐酸浓度可能是( )
| A.4.9 mol·l-1 | B.4.3 mol·L-1 |
| C.3.1 mol·L-1 | D.2.2 mol·L-1 |
过氧化氢溶液俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。回答下列有关双氧水的问题:
(1)下述反应中,H2O2仅体现氧化性的反应是 (填代号)。
A.Na2O2+2HCl 2NaCl+H2O2 2NaCl+H2O2 |
B.Ag2O+H2O2 2Ag+O2↑+H2O 2Ag+O2↑+H2O |
C.2H2O2 2H2O+O2↑ 2H2O+O2↑ |
D.3H2O2+Cr2(SO4)3+10KOH 2K2CrO4+3K2SO4+8H2O 2K2CrO4+3K2SO4+8H2O |
(2)保存双氧水的试剂瓶上最适合贴上的一个标签是 (填代号)。 
(3)H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称,如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O A+NH3↑,试指出生成物A的化学式为 。
A+NH3↑,试指出生成物A的化学式为 。
水热法制备纳米颗粒Y(化合物)的反应为3Fe2++2S2O32—+O2+aOH-=Y+S4O62—+2H2O,下列说法中,不正确的是( )
| A.a=4 |
| B.Y的化学式为Fe2O3 |
| C.S2O32—是还原剂 |
| D.每有1 mol O2参加反应,转移电子的总物质的量为4 mol |
在一密闭容器内有氧气、二氧化碳、水蒸气和一种未知物W,在一定条件下充分反应,测得反应前后各物质的质量如下表所示,则下列说法中错误的是( )
| 物 质 |
氧 气 |
二氧化碳 |
水蒸气 |
W |
| 反应前质量/g[ |
50 |
3 |
2 |
23 |
| 反应后质量/g |
2 |
47 |
29 |
x |
A.根据质量守恒定律,x的值应为0 B.反应后的生成物是二氧化碳和水
C.物质W只含碳和氢两种元素 D.物质W一定含碳、氢、氧三种元素
下列叙述中正确的是
| A.氧化还原反应中得失电子总数一定相等 |
| B.化学反应前后原子的总数一定不变 |
| C.电解质溶液中阴阳离子的总数一定相等 |
| D.分解反应一定是氧化还原反应 |
相同温度和压强下,3体积的X2气体与6体积的Y2气体化合生成6体积的气态化合物A,则生成物A的化学式为 ( )
| A.XY2 | B.X3Y2 | C.X2Y3 | D.XY |
若两物质恰好完全反应,下列各项中反应前后保持不变的是
①电子总数 ②原子总数 ③分子总数 ④物质的总能量 ⑤物质的总质量
| A.①②⑤ | B.①③⑤ | C.②③④ | D.②④⑤ |
有一种黄棕色气体X,其体积为20毫升,完全分解后生成10毫升的氯气和20毫升氧气(同温同压下测定),判断X为三原子分子依据的定律是( )
①质量守恒定律 ②能量守恒定律 ③能量最低原理 ④阿伏加德罗定律
| A.①② | B.①④ | C.②③ | D.②④ |
试题篮
()