某一反应物在一定条件下的平衡转化率为25.3%,当使用了催化剂时,其转化率为
| A.大于25.3% | B.小于25.3% | C.等于25.3% | D.不能确定 |
某温度下,反应SO2(g)+ 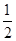 O2(g)
O2(g) SO3 (g) 的平衡常数K1=50,在同一温度下,反应SO3(g)
SO3 (g) 的平衡常数K1=50,在同一温度下,反应SO3(g) SO2(g) +
SO2(g) + 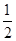 O2(g)的平衡常数K2的值为
O2(g)的平衡常数K2的值为
| A.2500 | B.100 | C.0.02 | D.0.001 |
一定温度下,可逆反应N2(g)+3H2(g) 2NH3 (g) 达到平衡状态标志的是
2NH3 (g) 达到平衡状态标志的是
A.A、B、C的分子数之比为1:3:2
B.单位时间内生成amol N2,同时生成amolNH3
C.每断裂1molN≡N,同时断裂3molH-H
D.每生成1mol N≡N,同时生成6molN-H
已知:在一定温度下,H2(g) + I2(g)  2 HI(g)的平衡常数为K1;1/2H2(g) + 1/2I2(g)
2 HI(g)的平衡常数为K1;1/2H2(g) + 1/2I2(g)  HI(g)的平衡常数为K2,则K1、K2的关系为
HI(g)的平衡常数为K2,则K1、K2的关系为
| A.K1=K2 | B.K1=2K2 | C.K1=1/2K2 | D.K1=K22 |
对于任何一个平衡体系,采用以下措施,一定会使平衡移动的是
| A.升高温度 | B.加入一种反应物 |
| C.对平衡体系增加压强 | D.使用催化剂 |
溴水中存在着如下的平衡:Br2+H2O HBr+HBrO,下列措施,不能使溶液颜色变浅的是
HBr+HBrO,下列措施,不能使溶液颜色变浅的是
| A.通入乙烯气体 | B.通入SO2气体 | C.加入NaF晶体 | D.加入NaI晶体 |
下列反应不是可逆反应的是
| A.CO2+H2O=H2CO3和H2CO3=CO2+H2O |
B.2H2O 2H2↑+O2↑和2H2+O2点燃2H2O 2H2↑+O2↑和2H2+O2点燃2H2O |
C.2SO2+O2 2SO3和2SO3 2SO3和2SO3 2SO2+O2 2SO2+O2 |
| D.H2+I2 △ 2HI和2HI △ H2+I2 |
当反应COCl2(g) CO(g)+Cl2(g) ΔH>0达到平衡时,下列措施:
CO(g)+Cl2(g) ΔH>0达到平衡时,下列措施:
①升温 ②恒容通入惰性气体 ③增加CO的浓度
④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是( )
| A.①②④ | B.①④⑥ | C.②③⑥ | D.③⑤⑥ |
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。 向其中一份中逐渐加入铜粉,最多能溶解19.2 g。向另一份中逐渐 加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示。下列分析或结果错误的是( )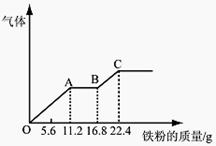
| A.原混合酸中NO3-物质的量浓度为2 mol/L |
| B.OA段产生的是NO,AB段的反应为 Fe+2Fe3+=3Fe2+,BC段产生氢气 |
| C.第二份溶液中最终溶质为FeSO4 |
| D.H2SO4浓度为2.5 mol·L-1 |
对于平衡体系mA(g)+nB(g)  pC(g)+qD(g) ΔH<0。下列结论中错误的是
pC(g)+qD(g) ΔH<0。下列结论中错误的是
A.若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q
B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m∶n
C.若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a
D.若温度不变压强增大到原来的2倍,达到新平衡时,总体积一定比原来的1/2要小
关于下列各图的叙述,正确的是
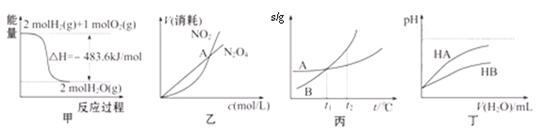
A.甲表示H2与O2发生反应过程中的能量变化,则H2的标准燃烧热(△H)为—241.8 kJ·mol-1
B.乙表示恒温恒容条件下,2NO2(g) N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将tl℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB溶液的pH
在容积为2L的密闭容器中进行反应:CO(g)+2H2(g) CH3OH(g),其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图,下列说法正确的是
CH3OH(g),其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图,下列说法正确的是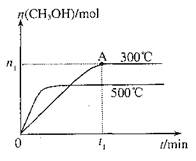
| A.该反应的△H<0 |
| B.其他条件不变,升高温度反应的平衡常数增大 |
C.300℃时,0–t1 min内CH3OH的平均生成速率为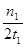 mol•L-1 min-1 mol•L-1 min-1 |
D.A点的反应体系从300℃升高到500℃,达到平衡时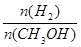 减小 减小 |
将1 mol CO和2 mol H2充入一容积为1L的密闭容器中,分别在250°C、T°C下发生反应:CO(g)+2H2(g)=CH3OH(g),ΔH="a" kJ/mol,如图。下列分析中正确的是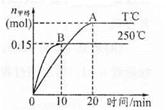
A.250°C时,0〜10minH2反应速率为 0.015 mol,/(L.min)
B.平衡时CO的转化率:T℃时小于250℃时
C.其他条件不变,若减小容积体积,CO体积分数增大
D.a<0,平衡常数K:T0C时大于2500C
某密闭容器中存在2NO+O2 2NO2反应,平衡时NO的转化率与温度变化关系如图所示(曲线上任何一点都表示平衡状态),下列说法中正确的是
2NO2反应,平衡时NO的转化率与温度变化关系如图所示(曲线上任何一点都表示平衡状态),下列说法中正确的是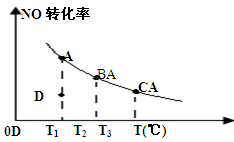
| A.该反应的正反应是吸热反应 |
| B.若温度为T1、T3时的平衡常数分别为K1、K3,则K1<K3 |
| C.T1时,当反应处于D点,则该反应的逆反应速率大于正反应速率 |
| D.如果缩小容器体积,则平衡时表示NO转化率与温度变化关系的曲线在原曲线上方 |
试题篮
()