在一定条件下发生反应3A(g)+2B(g)  zC(g)+2D(g),在2 L 的密闭容器中把 4 mol A 和 2 mol B 混合,2 min 后反应达到平衡时生成 1.6 mol C,又测得反应速率v(D)="0.2" mol·(L·min) -1。则下列说法不正确的是
zC(g)+2D(g),在2 L 的密闭容器中把 4 mol A 和 2 mol B 混合,2 min 后反应达到平衡时生成 1.6 mol C,又测得反应速率v(D)="0.2" mol·(L·min) -1。则下列说法不正确的是
A.z=4 B.B 的转化率是40%
C.A 的平衡浓度是1.4 mol·L-1 D.平衡时气体压强是原来压强的0.9
下列关于平衡常数的说法中,正确的是
| A.化学平衡常数用来定量描述化学反应的限度 |
| B.利用化学平衡常数判断化学反应进行的快慢 |
| C.平衡常数的大小与温度、浓度、压强、催化剂有关 |
| D.对于一个化学反应达到平衡之后,若只改变一个因素使得平衡发生移动,则K值一定变化 |
下列关于化学反应限度的说法中正确的是
| A.改变外界条件不能改变化学反应的限度 |
| B.当某反应在一定条件下达到反应限度时即达到了化学平衡状态 |
| C.当某反应体系中气体的压强不再改变时,该反应一定达到了反应限度 |
| D.当某反应达到限度时,反应物和生成物的浓度一定相等 |
一定温度下,反应2SO2+O2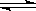 2SO3,达到平衡时,n (SO2):n(O2):n(SO3)=2:3:4。缩小体积,反应再次达到平衡时,n(O2)="0.8" mol,n(SO3)="1.4" mol,此时SO2的物质的量应是
2SO3,达到平衡时,n (SO2):n(O2):n(SO3)=2:3:4。缩小体积,反应再次达到平衡时,n(O2)="0.8" mol,n(SO3)="1.4" mol,此时SO2的物质的量应是
| A.1.2 mol | B.0.8 mol | C.0.6 mol | D.0.4 mol |
反应4A(g)+5B(g) 4C(g)+6D(g) △H =-Q,在一定温度下达到化学平衡状态时,下列说法正确的是
4C(g)+6D(g) △H =-Q,在一定温度下达到化学平衡状态时,下列说法正确的是
A. 单位时间里生成n mol C,同时生成1.5n mol D
B. 增大压强正反应速率增大,逆反应速率减小
C. 单位时间里有4n mol A消耗,同时有5n mol B生成
D. 容器里A、B、C、D的浓度比是4:5:4:6
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述正确的是
A.反应的化学方程式:2N M M |
| B.t2时,正、逆反应速率相等,达到平衡 |
| C.t3时,正反应速率大于逆反应速率 |
| D.反应开始时只投入了N |
合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为
CO(g)+ H2O(g)  CO2(g) + H2(g) ΔH<0反应达到平衡后,为提高CO的转化率,下列措施中正确的是
CO2(g) + H2(g) ΔH<0反应达到平衡后,为提高CO的转化率,下列措施中正确的是
| A.增加压强 | B.降低温度 | C.增大CO 的浓度 | D.更换催化剂 |
下列事实中,不能用勒夏特列原理解释的是 ( )
| A.高压有利于氨的合成 |
| B.实验室中常用排饱和食盐水的方式收集氯气 |
| C.打开汽水瓶,有气泡从溶液中冒出 |
| D.向双氧水中加入二氧化锰有利于氧气的生成 |
对于可逆反应M+N Q达到平衡时,下列说法正确的是
Q达到平衡时,下列说法正确的是
| A.M、N、Q三种物质的浓度一定相等 |
| B.M、N全部变成了Q |
| C.反应物和生成物的浓度都保持不变 |
| D.反应已经停止 |
N2(g)+3H2(g) 2NH3(g) △H<0,当反应达到平衡时,下列措施能提高N2转化率的是
2NH3(g) △H<0,当反应达到平衡时,下列措施能提高N2转化率的是
①降温 ②恒压通入惰性气体 ③增加N2的浓度 ④加压
| A.③④ | B.①② | C.②③ | D.①④ |
298K时,在容积不变的密闭容器中注满NO2气体,2NO2(g)⇌N2O4(g)△H<0.平衡后把该容器置于沸水中,下列性质或数值不会改变的是( )
①颜色 ②平均摩尔质量 ③质量 ④压强 ⑤密度.
| A.①② | B.②③ | C.④⑤ | D.③⑤ |
在一密闭烧瓶中,在25℃时存在着平衡:

 (正反应放热)。把烧瓶置于100℃的水中,则下列几项性质中不会改变的是( )
(正反应放热)。把烧瓶置于100℃的水中,则下列几项性质中不会改变的是( )
①颜色; ②平均相对分子质量; ③质量; ④压强; ⑤密度
| A.①和③ | B.②和④ | C.③和⑤ | D.④和⑤ |
试题篮
()