下列关于平衡移动的说法不正确的是( )
| A.当v(正)=v(逆)时,平衡不移动 |
| B.当v(正)>v(逆)时,平衡向正反应方向移动 |
| C.当v(正)<v(逆)时,平衡向正反应方向移动 |
| D.反应速率发生改变,平衡不一定发生移动 |
电镀废液中Cr2O72-可通过下列反应转化成铬黄(PbCrO4):
Cr2O72-(aq)+2Pb2+(aq)+H2O(l) 2 PbCrO4(s)+2H+(aq) ΔH< 0
2 PbCrO4(s)+2H+(aq) ΔH< 0
该反应达平衡后,改变横坐标表示的反应条件,下列示意图正确的是
某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中p表示压强,T表示温度,n表示物质的量):

根据以上规律判断,下列结论正确的是( )
| A.反应Ⅰ:ΔH>0,p2>p1 |
| B.反应Ⅱ:ΔH<0,T1>T2 |
| C.反应Ⅲ:ΔH>0,T2>T1或ΔH<0,T2<T1 |
| D.反应Ⅳ:ΔH<0,T2>T1 |
某可逆反应当正反应速率增大时,下列说法正确的是
| A.逆反应速率一定增大 | B.平衡一定向正反应方向进行 |
| C.反应物的转化率一定增大 | D.该反应的条件一定发生变化 |
在 0.1mol·L-1 CH3COOH溶液中存在如下电离平衡:CH3COOH  CH3COO-+H+,对于该平衡,下列叙述中,正确的是( )
CH3COO-+H+,对于该平衡,下列叙述中,正确的是( )
| A.加入水时,平衡向逆反应方向移动 |
| B.加入少量NaOH固体,平衡向正反应方向移动 |
| C.加入少量0.1 mol·L-1 HCl溶液,溶液中C(H+)减小 |
| D.加入少量CH3COONa固体,平衡向正反应方向移动 |
吸热反应N2(g)+O2(g) 2NO(g),在2000℃时K=6.2×10-4。2000℃时,向10L密闭容器中放入3×10-3molNO、2.50×10-1molN2和4.00×10-2molO2。
2NO(g),在2000℃时K=6.2×10-4。2000℃时,向10L密闭容器中放入3×10-3molNO、2.50×10-1molN2和4.00×10-2molO2。
通过计算回答:
(1)此反应的初始状态是否为化学平衡状态?
(2)若非化学平衡状态,反应将向哪个方向进行以达到化学平衡状态?
t℃时,将3molA和1molB气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A(g)+B(g) xC(g).2min时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:
xC(g).2min时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)从反应开始至达到平衡状态,生成C的平均反应速率为 .
(2)x= ;平衡常数K= .
(3)若继续向原平衡混合物的容器中通入少量氦气(假设氦气和A、B、C都不反应)后,化学平衡(填字母) .
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
(4)若向原平衡混合物的容器中再充入amolC,在t℃时达到新的平衡,此时B的物质的量为n(B)= mol.
(5)如果上述反应在相同温度和容器中进行,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入三种物质的物质的量n(A)、n(B)、n(C)之间应该满足的关系式为 .
FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:
(1)FeCl3净水的原理是(用离子方程式表示) 。FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示) 。
(2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。
①若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1,c(Fe3+)=1.0×10-3mol·L-1,
c(Cl-)=5.3×10-2mol·L-1,则该溶液的PH约为 。
②完成NaClO3氧化FeCl2的离子方程式:
□ClO3―+□Fe2++□ =□Cl―+□Fe3++□ 。
(3)生成聚合氧化铁的离子方程式为:xFe3++yH2O Fex(OH)y(3x-y)++yH+ 欲使平衡正向移动可采用的方法是(填序号) 。
Fex(OH)y(3x-y)++yH+ 欲使平衡正向移动可采用的方法是(填序号) 。
a.降温 b.加水稀释 c.加入NH4Cl d.加入NaHCO3
一定温度下,在容积为1L的密闭容器中,存在如下关系:xH2O(g)  (H2O)x(g),反应物和生成物的物质的量随时间的变化关系如图。下列说法不正确的是
(H2O)x(g),反应物和生成物的物质的量随时间的变化关系如图。下列说法不正确的是
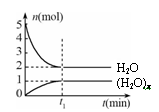
| A.x=3 |
| B.该温度下,反应的平衡常数为0.125 L2/mol2 |
| C.平衡时混合气体的平均摩尔质量是30 |
| D.t1时刻,保持温度不变,再充入1 molH2O(g), |
重新达到平衡时,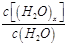
 将增大
将增大
25℃时,水的电离达到平衡:H2O H++OH―;ΔH>0,下列叙述正确的是
H++OH―;ΔH>0,下列叙述正确的是
| A.向水中加人稀氨水,平衡逆向移动,c(OH―)降低 |
| B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 |
| C.向水中加人少量固体NaCl,平衡逆向移动,c(H+)降低 |
| D.将水加热,Kw增大,pH不变 |
在一定温度下,反应A2(g)+B2(g)  2AB(g)达到平衡的标志是
2AB(g)达到平衡的标志是
| A.单位时间内生成n mol A2,同时生成n mol AB |
| B.容器内总压强不随时间改变 |
| C.任何时间内A2、B2的物质的量之比为定值 |
| D.单位时间内生成2n mol AB同时生成n mol B2 |
臭氧是理想的烟气脱硝试剂,其脱硝反应为:2NO2(g)+O3(g) N2O5(g)+O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是
N2O5(g)+O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是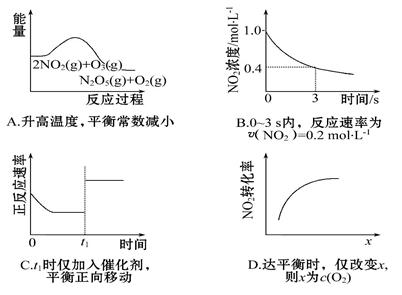
在一定温度下的定容密闭容器中,表明反应:A(g)+2B(g)  C(g)+D(g)已达到平衡状态的是( )
C(g)+D(g)已达到平衡状态的是( )
A. A、C、D的物质的量浓度相等 B. 混合气体的密度不再改变
C. 气体的总物质的量不再改变 D. v(B) = 2v(C)
在容积不变的密闭容器中:N2 + 3H2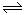 2NH3,下列不能说明反应已平衡的是:
2NH3,下列不能说明反应已平衡的是:
| A.容器内的压强不变 | B.单位时间内,消耗1 mol N2的同时,生成2 molNH3 |
| C.混合气体的相对分子质量不变 | D.混合物的总物质的量不变 |
试题篮
()