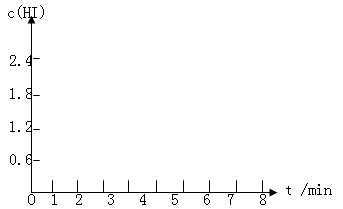
将0.8 mol I2(g)和1.2 mol H2(g)置于某1L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)  2HI(g)并达到平衡。HI的体积分数随时间的变化如表格所示:
2HI(g)并达到平衡。HI的体积分数随时间的变化如表格所示:
| HI体积分数 |
1min |
2min |
3min |
4min |
5min |
6min |
7min[ |
| 条件I |
26% |
42% |
52% |
57% |
60% |
60% |
60% |
| 条件II |
20% |
33% |
43% |
52% |
57% |
65% |
65% |
(1)在条件I到达平衡时,计算该反应的平衡常数K,要求列出计算过程。
(2)在条件I从开始反应到到达平衡时,H2的反应速率为____________。
(3)为达到条件II的数据,对于反应体系可能改变的操作是_______________。
(4)该反应的△H__________0(填">","<"或"=")
(5)在条件I下达到平衡后,在7min时将容器体积压缩为原来的一半。请在图中画出c(HI)随时间变化的曲线。
t℃时,将3molA和1molB气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A(g)+B(g) xC(g).2min时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:
xC(g).2min时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)从反应开始至达到平衡状态,生成C的平均反应速率为 .
(2)x= ;平衡常数K= .
(3)若继续向原平衡混合物的容器中通入少量氦气(假设氦气和A、B、C都不反应)后,化学平衡(填字母) .
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
(4)若向原平衡混合物的容器中再充入amolC,在t℃时达到新的平衡,此时B的物质的量为n(B)= mol.
(5)如果上述反应在相同温度和容器中进行,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入三种物质的物质的量n(A)、n(B)、n(C)之间应该满足的关系式为 .
FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:
(1)FeCl3净水的原理是(用离子方程式表示) 。FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示) 。
(2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。
①若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1,c(Fe3+)=1.0×10-3mol·L-1,
c(Cl-)=5.3×10-2mol·L-1,则该溶液的PH约为 。
②完成NaClO3氧化FeCl2的离子方程式:
□ClO3―+□Fe2++□ =□Cl―+□Fe3++□ 。
(3)生成聚合氧化铁的离子方程式为:xFe3++yH2O Fex(OH)y(3x-y)++yH+ 欲使平衡正向移动可采用的方法是(填序号) 。
Fex(OH)y(3x-y)++yH+ 欲使平衡正向移动可采用的方法是(填序号) 。
a.降温 b.加水稀释 c.加入NH4Cl d.加入NaHCO3
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:
A(g)+xB(g) 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度随时间变化如下图所示。设35min和55min的平衡常数分别为K1、K2。
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度随时间变化如下图所示。设35min和55min的平衡常数分别为K1、K2。

回答下列问题:
(1)反应方程式中的x= ;20min时的平衡常数 K = 。
(2)8min时A的转化率为 。
(3)30min时改变的条件是 。
(4)若40min时改变的条件是升高温度,则K1 K2(填“>”或“<”或“=”, 下同)。
(5)能判断反应A(g)+xB(g) 2C(g),达到化学平衡状态的依据是 (填序号)。
2C(g),达到化学平衡状态的依据是 (填序号)。
A.恒容容器中压强不变 B.混合气体中c(A)不变
C.2v正(A)= v逆(C) D.2c(A)= c(C)
大气中的部分碘源于O3对海水中I¯的氧化。某科学小组进行O3与含I¯溶液反应的相关研究。
(1)O3将I¯氧化生成I2的过程由3步反应组成:
① I¯(aq)+ O3(g)="==" IO¯(aq)+O2(g) △H1
② IO¯(aq)+H+(aq) HOI(aq) △H2
HOI(aq) △H2
③ HOI(aq) + I¯(aq) + H+(aq) I2(aq) + H2O(l) △H3
I2(aq) + H2O(l) △H3
用热化学方程式表示O3氧化I¯生成I2的反应____________________。
(2)O3在水中易分解,一定条件下,O3的浓度减少一半时所需的时间(t)如下表所示。已知:O3的起始浓度为0.0216 mol/L。
 |
3.0 |
4.0 |
5.0 |
6.0 |
| 20 |
301 |
231 |
169 |
58 |
| 30 |
158 |
108 |
48 |
15 |
| 50 |
31 |
26 |
15 |
7 |
① 在30℃、pH=4.0条件下,O3的分解速率为__________mol/(L·min)。
② pH增大能加速O3分解,表明对O3分解起催化作用的是___________。
③ 根据表中数据,推测O3在下列条件下分解速率依次增大的顺序为_________(填字母代号)。
a.40℃、pH=3.0 b.10℃、pH=4.0 c.30℃、pH=7.0
(3)I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)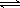 I3-(aq)。测得不同温度下该反应的平衡常数如图1所示,下列说法正确的是_____________。
I3-(aq)。测得不同温度下该反应的平衡常数如图1所示,下列说法正确的是_____________。
A.反应I2(aq)+I-(aq) 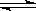 I3-(aq)的ΔH>0
I3-(aq)的ΔH>0
B.利用该反应可以除去硫粉中少量的碘单质
C.在上述平衡体系中加入苯,平衡不移动
D.25℃时,在上述平衡体系中加入少量KI固体,平衡常数K小于680
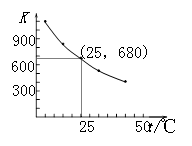

图1 图2
(4)将I2溶于CCl4中,得到紫红色的溶液,再加入一定浓度的KI溶液,现象如图2所示:
①上层溶液中含碘元素的微粒有____________________(用化学符号表示)。
②由实验现象可推测关于I2溶解性的结论是_________________________。
某些天然气开采中含有H2S气体,为了安全、有效地利用这一资源,提高经济价值,工业上可以采取多种处理方式。
Ⅰ.吸收:
(1)加工过程中常用氨水吸收H2S,产物为NH4HS,请写出对应的化学方程式: 。
Ⅱ.再利用:加工过程中产生的H2S废气可用来制H2,既廉价又环保。工业上采用以下两种方法制备H2
1高温热分解法
已知:H2S(g) H2(g)+S(g) △H
H2(g)+S(g) △H
在恒容密闭容器中,控制不同温度进行H2S分解实验。以H2S起始浓度均为c mol·L-1测定H2S的转化率,结果见图。请回答:

(2)△H 0(填 “>”或者“<”),你判断的依据是: 。
ii.图中a为H2S的平衡转化率与温度关系曲线,
(3)据图计算985℃时H2S按上述反应分解的平衡常数K=________
2电化学法
已知:该法制氢过程的示意图如右,FeCl3溶液可作为H2S的吸收液。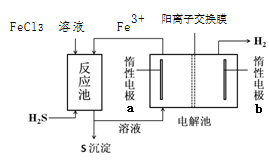
请回答:
(4)反应池中发生反应的离子方程式为_____________。
(5)请结合化学用语解释说明该装置能够产生H2的原因 。
(6)该装置除了能够制氢外,还具有何种优点?请你评价 。
研究氨氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) K1 ΔH1<0(Ⅰ)
NaNO3(s)+ClNO(g) K1 ΔH1<0(Ⅰ)
2NO(g)+Cl2(g) 2ClNO(g) K2 ΔH2<0(Ⅱ)
2ClNO(g) K2 ΔH2<0(Ⅱ)
(1)4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=__________(用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=__________(用K1、K2表示)。
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol Cl2,10 min时反应(Ⅱ)达到平衡。测得10 min内v(ClNO)=7.5×10-3 mol·L-1·min-1,则平衡后n(Cl2)=________mol,NO的转化率α1=_______。其他条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率α2_____α1(填“>”“<”或“=”),平衡常数K2__________(填“增大”“减小”或“不变”)。若要使K2减小,可采取的措施是______________。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH===NaNO3+NaNO2+H2O。含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应得1 L溶液A,溶液B为0.1 molL的CH3COONa溶液,则两溶液中c(NO3-)、c(NO2-)和c(CH3COO-)由大到小的顺序为_________________。(已知HNO2电离常数Ka=7.1×10-4 mol·L-1,CH3COOH的电离常数Ka=1.7×10-5 mol·L-1)
可使溶液A和溶液B的pH相等的方法是____________。
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
综合利用CO2、CO对构建低碳社会有重要意义。
(1)固体氧化物电解池(SOEC)用于高温电解CO2和H2O的混合气体,既可高效制备合成气(CO+H2),又可实现CO2的减排,其工作原理如图。

①b为电源的 (填“正极”或“负极”)
②写出电极c发生的电极反应式 、 。
(2)电解生成的合成气在催化剂作用下发生如下反应:CO(g) +2H2(g) CH3OH(g)。对此反应进行如下研究:某温度下在一恒压容器中分别充入1.2mol CO和1mol H2,达到平衡时容器体积为2L,且含有0.4mol CH3OH(g),则该反应平衡常数值为 ,此时向容器中再通入0.35molCO气体,则此平衡将 移动(填“向正反应方向”、“不”或“逆反应方向”)。
CH3OH(g)。对此反应进行如下研究:某温度下在一恒压容器中分别充入1.2mol CO和1mol H2,达到平衡时容器体积为2L,且含有0.4mol CH3OH(g),则该反应平衡常数值为 ,此时向容器中再通入0.35molCO气体,则此平衡将 移动(填“向正反应方向”、“不”或“逆反应方向”)。
铁及其化合物在生产、生活中有广泛应用.请回答下列问题:
(一)高炉炼铁过程中发生的主要反应为:
 Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)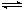
 Fe(s)+CO2(g)
Fe(s)+CO2(g)
已知该反应在不同温度下的平衡常数 如下:
温度/℃ 1000 1115 1300
平衡常数 4.0 3.7 3.5
(1)该反应的平衡常数表达式K=___;△H___0(填“>”、“<”或“=”).
(2)欲提高上述反应中CO的平衡转化率,可采取的措施是_____.
| A.提高反应温度 | B.移出部分CO2 |
| C.加入合适的催化剂 | D.减小容器的容积 |
(3)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,此时υ正___υ逆(填“>”、“<”或“=”).经过10min,在1000℃达到平衡,则该时间范围内反应的平均反应速率υ(CO2)=_____.
(二)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂.
(4)一定条件下Fe(OH)3与KClO在KOH溶液中反应可制得K2FeO4,其中反应的氧化剂是_____;生成1mol K2FeO4转移电子的物质的量是_____mol.
Ⅰ.图1是某压强下工业合成氨生产过程中,N2与H2按体积比为1:3投料时,反应混合物中氨的体积分数随温度的变化曲线,其中一条是经过一定时间反应后的曲线,另一条是平衡时的曲线。
(1)图中表示该反应的平衡曲线的是__________(填“Ⅰ”或“Ⅱ”);由图中曲线变化趋势可推知工业合成氨的反应是___________(填“吸热”或“放热”)反应。
(2)图中a点,容器内气体n(N2):n(NH3)= ____________,图中b点,v(正)_________v(逆)(填“>”、“=”或“<”)。
Ⅱ.以工业合成氨为原料,进一步合成尿素的反应原理为:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g)
CO(NH2)2(l)+H2O(g)
工业生产时,需要原料气带有水蒸汽,图2中曲线I、Ⅱ、Ⅲ表示在不同水碳比[n(H2O)/n(CO2)]时,CO2的转化率与氨碳比[n(NH3)/n(CO2)]之间的关系。
(1)写出该反应的化学平衡常数表达式____________________
(2)曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是_________,判断依据是_______________
(3)测得B点氨的转化率为40%,则x1=__________。
氯化铁是常见的水处理剂,工业上制备无水FeCl3的一种工艺如下:
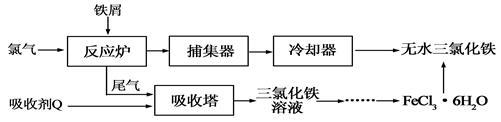
(1)试写出吸收塔中吸收剂Q反应的离子方程式: 。
(2)六水合氯化铁在水中的溶解度如下:
| 温度/℃ |
0 |
10 |
20 |
30 |
50 |
80 |
100 |
| 溶解度(g/100gH2O) |
74.4 |
81.9 |
91.8 |
106.8 |
315.1 |
525.8 |
535.7 |
从FeCl3溶液制得FeCl3·6H2O晶体的操作步骤是:加入少量盐酸、 、 、过滤、洗涤、干燥。再由FeCl3·6H2O晶体得到无水FeCl3的操作是: 。
(3)常温下,若溶液的pH控制不当会使Fe3+沉淀,pH=4时,溶液中c(Fe3+)= mol·L-1。(常温下Ksp[Fe(OH)3]=4×10-38)。
(4)氯化铁溶液称为化学试剂中的“多面手”,写出SO2通入氯化铁溶液中反应的离子方程式 。
(5)向氯化铜和氯化铁的混合溶液中加入氧化铜粉末会产生新的沉淀,写出该沉淀的化学 。请用平衡移动的原理,结合必要的离子方程式,对此现象作出解释 。
根据下表所示化学反应与数据关系:
| 化学反应 |
平衡常数 |
温度 |
|
| 973K |
1173K |
||
① |
 |
1.47 |
2.15 |
②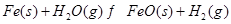 |
 |
2.38 |
1.67 |
③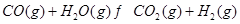 |
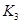 |
? |
? |
请回答:
(1)反应①是 (填“吸热”或“放热”)反应。
(2)根据反应①与②可推导出K1、K2与K3之间的关系,则K3= (用K1、K2表示)。
(3)要使反应③在一定条件下建立的平衡向逆反应方向移动,可采取的措施有 (填写字母序号)。
A 缩小反应容器的容积 B 扩大反应容器的容积 C 升高温度
D 使用合适的催化剂 E 设法减小平衡体系中的CO的浓度
(4)若反应③的逆反应速率与时间的关系如图所示:

①可见反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的是什么条件:t2时 ,t8时 。
②若t4时降压,t6时增大反应物的浓度,请在图中画出 ~
~ 时逆反应速率与时间的关系线。
时逆反应速率与时间的关系线。
如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2 mol SO2和1 mol O2,乙中充入2 mol SO3和1 mol He,此时K停在0处。在一定条件下发生可逆反应:2SO2(g)+O2(g) 2SO3(g),反应达到平衡后,再恢复至原温度。回答下列问题:
2SO3(g),反应达到平衡后,再恢复至原温度。回答下列问题:
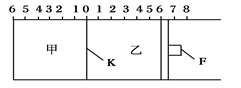
(1)达到平衡后隔板K是否可能处于0刻度_______(填“可能”或“不可能”)。若K最终停留在0刻度左侧a处,则a一定小于________。
(2)若平衡时,K最终停留在左侧刻度1处,则甲中SO3的物质的量为__ __mol,乙中SO3的转化率________50%(填“>”、“<”或“=”),活塞F最终停留在右侧刻度________处(填下列序号:①<6 ②>6 ③=6)。

(3)若一开始就将K、F固定,其他条件均不变,则平衡时,甲、乙中SO3的物质的量分数是甲________乙(填“>”、“<”或“=”);测得甲中SO2的转化率为w%,则乙中SO3的转化率等于________。
(4)平衡后将甲容器的混合气的1.0%通入足量Ba (NO3)2溶液,生成的BaSO4质量为________g。
T ℃时,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示。
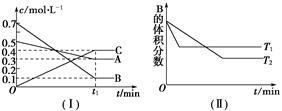
根据以上条件,回答下列问题:
(1)A与B反应生成C的化学方程式为 ,正反应为________(填“吸热”或“放热”)反应。
(2)在密闭容器中,加入2 mol A和6 mol B。
① 当反应达到平衡时,A和B的浓度比是_______;A和B的转化率之比是_______。
② 升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量________。(填“变大”、“变小”或“不变”)
③ 当达到平衡时,充入氩气,并保持压强不变,平衡将______(填“正向”、“逆向”或“不”)移动。
④ 若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将________(填“正向”、“ 逆向”或“不移动”)。达到新平衡后,容器内温度________(填“大于”、“小于”或“等于”)原来的2倍。
使用石油热裂解的副产物CH4来制取CO和H2,其生产流程如下图:

(1)工业上常利用反应Ⅰ产生的CO和H2合成可再生能源甲醇。
①已知CO(g)、CH3OH(l)的燃烧热分别为283.0 kJ·mol-1和726.5 kJ·mol-1,则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为 。
(2)此流程的第I步反应为:CH4(g) + H2O(g)  CO(g) + 3H2(g),一定条件下CH4的平衡转化率与温度、压强的关系如图。则P1_________P2。(填“<”、“>”或“=”)100℃时,将1 mol CH4和2 mol H2O通入容积为10L的恒容密闭容器中,达到平衡时CH4的转化率为0.5。此时该反应的平衡常数K=____________。
CO(g) + 3H2(g),一定条件下CH4的平衡转化率与温度、压强的关系如图。则P1_________P2。(填“<”、“>”或“=”)100℃时,将1 mol CH4和2 mol H2O通入容积为10L的恒容密闭容器中,达到平衡时CH4的转化率为0.5。此时该反应的平衡常数K=____________。

(3)此流程的第II步反应CO(g) + H2O(g)  CO2(g) + H2(g),
CO2(g) + H2(g),
的平衡常数随温度的变化如下表:
| 温度/℃ |
400 |
500[ |
830 |
| 平衡常数K |
10 |
9 |
1 |
从上表可以推断:该反应是 反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol/L,在该条件下,反应达到平衡时,CO的转化率为 。
右图表示该反应在t1时刻达到平衡、在t2时刻因改变某个条件引起浓度变化的情况:图中t2时刻发生改变的条件是____(写出一种)。

(4)某化学兴趣小组构想将NO转化为HNO3(NO3-),装置如图,电极为多孔惰性材料。则负极的电极反应式是 。

试题篮
()