下列不属于可逆反应的是
A.Pb+PbO2+4H++2SO42- 2PbSO4+2H2O 2PbSO4+2H2O |
B.2SO2+O2 2SO3 2SO3 |
C.Cl2+H2O HCl+HClO HCl+HClO |
D.2NO2 N2O4 N2O4 |
甲醇是一种可再生能源,在日常生活中有着广泛的应用.工业上用CO生产燃料甲醇,如:CO(g)+2H2(g)⇌CH3OH(g).图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化.
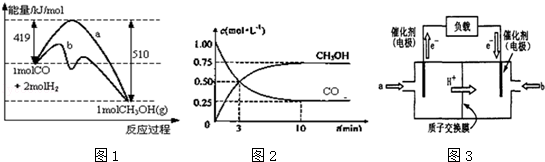
请回答下列问题:
(1)图1表示使用和未使用催化剂时反应过程和能量的对应关系.下列有关催化剂的说法不正确是
| A.降低分子的能量 | B.增加了活化分子数 |
| C.提高了活化分子百分数 | D.增加了单位体积内的活化分子数 |
(2)从反应开始到建立平衡,该过程中释放 kJ热量.
(3)在T2℃下,将2molCO和6molH2充入2L的密闭容器中,达到平衡状态时,测得c(CO)=0.2mol•L﹣1,则CO的转化率为 .
(4)如图3为常用笔记本电脑所用甲醇质子交换膜燃料电池的结构示意图如.电池总反应为2CH3OH+3O2⇌2CO2+4H2O.在电脑的使用过程中,电池的温度往往因为各种原因会升高.温度升高_____________(填:“有利于”或“不利于”)电池将化学能转化为电能.该装置中___________(填:“a”或“b”)为电池的负极,该电极反应式为 .
恒温下在密闭容器中进行的反应2SO2 + O2 2SO3 达到平衡状态的标志是
2SO3 达到平衡状态的标志是
| A.容器中SO2、O2、SO3共存 |
| B.容器中SO2和SO3 浓度相同 |
| C.容器中n(SO2)∶n(O2)∶n(SO3)=2∶1∶2 |
| D.容器中压强不随时间而改变 |
将0.8 mol I2(g)和1.2 mol H2(g)置于某1L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)  2HI(g)并达到平衡。HI的体积分数随时间的变化如表格所示:
2HI(g)并达到平衡。HI的体积分数随时间的变化如表格所示:
| HI体积分数 |
1min |
2min |
3min |
4min |
5min |
6min |
7min[ |
| 条件I |
26% |
42% |
52% |
57% |
60% |
60% |
60% |
| 条件II |
20% |
33% |
43% |
52% |
57% |
65% |
65% |
(1)在条件I到达平衡时,计算该反应的平衡常数K,要求列出计算过程。
(2)在条件I从开始反应到到达平衡时,H2的反应速率为____________。
(3)为达到条件II的数据,对于反应体系可能改变的操作是_______________。
(4)该反应的△H__________0(填">","<"或"=")
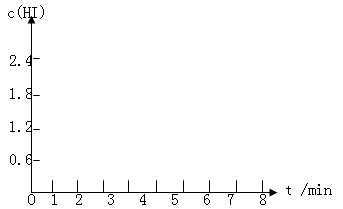
(5)在条件I下达到平衡后,在7min时将容器体积压缩为原来的一半。请在图中画出c(HI)随时间变化的曲线。
某温度下,反应SO2(g)+ O2(g)
O2(g) SO3(g)的平衡常数K1=50,在同一温度下,反应2SO3(g)
SO3(g)的平衡常数K1=50,在同一温度下,反应2SO3(g) 2SO2(g)+O2(g)的平衡常数K2的值为
2SO2(g)+O2(g)的平衡常数K2的值为
| A.2500 | B.100 | C.4×10-4 | D.2×10-2 |
向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g)⇌SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如右所示.由图可得出的正确结论是
| A.反应在c点达到平衡状态 |
| B.反应物浓度:a点小于b点 |
| C.反应物的总能量低于生成物的总能量 |
| D.△t1=△t2时,SO2的转化率:a~b段小于b~c段 |
下列事实不能用勒夏特例原理解释的是
| A.红棕色的NO2加压后颜色先变深后变浅 |
| B.实验室中常用排饱和食盐水的方法收集氯气 |
| C.合成氨气反应 N2 + 3H2 = 2NH3(正反应放热)中使用催化剂 |
| D.SO2催化氧化成SO3的反应,使用过量空气以提高二氧化硫的转化率 |
已知A(g)+B(g) C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
| 温度/ ℃ |
700 |
800 |
830 |
1000 |
1200 |
| 平衡常数 |
1.7 |
1.1 |
1.0 |
0.6 |
0.4 |
830℃时,向一个2 L的密闭容器中充入0.2mol的A和0.8mol的B,反应初始4 s内A的平均反应速率v(A)=0.005 mol/(L·s)。下列说法正确的是
A.4 s时c(B)为0.76 mol/L
B.830℃达平衡时,A的转化率为80%
C.反应达平衡后,升高温度,平衡正向移动
D.1200℃时反应C(g)+D(g)  A(g)+B(g)的平衡常数的值为0.4
A(g)+B(g)的平衡常数的值为0.4
吸热反应N2(g)+O2(g) 2NO(g),在2000℃时K=6.2×10-4。2000℃时,向10L密闭容器中放入3×10-3molNO、2.50×10-1molN2和4.00×10-2molO2。
2NO(g),在2000℃时K=6.2×10-4。2000℃时,向10L密闭容器中放入3×10-3molNO、2.50×10-1molN2和4.00×10-2molO2。
通过计算回答:
(1)此反应的初始状态是否为化学平衡状态?
(2)若非化学平衡状态,反应将向哪个方向进行以达到化学平衡状态?
t℃时,将3molA和1molB气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A(g)+B(g) xC(g).2min时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:
xC(g).2min时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)从反应开始至达到平衡状态,生成C的平均反应速率为 .
(2)x= ;平衡常数K= .
(3)若继续向原平衡混合物的容器中通入少量氦气(假设氦气和A、B、C都不反应)后,化学平衡(填字母) .
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
(4)若向原平衡混合物的容器中再充入amolC,在t℃时达到新的平衡,此时B的物质的量为n(B)= mol.
(5)如果上述反应在相同温度和容器中进行,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入三种物质的物质的量n(A)、n(B)、n(C)之间应该满足的关系式为 .
FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:
(1)FeCl3净水的原理是(用离子方程式表示) 。FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示) 。
(2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。
①若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1,c(Fe3+)=1.0×10-3mol·L-1,
c(Cl-)=5.3×10-2mol·L-1,则该溶液的PH约为 。
②完成NaClO3氧化FeCl2的离子方程式:
□ClO3―+□Fe2++□ =□Cl―+□Fe3++□ 。
(3)生成聚合氧化铁的离子方程式为:xFe3++yH2O Fex(OH)y(3x-y)++yH+ 欲使平衡正向移动可采用的方法是(填序号) 。
Fex(OH)y(3x-y)++yH+ 欲使平衡正向移动可采用的方法是(填序号) 。
a.降温 b.加水稀释 c.加入NH4Cl d.加入NaHCO3
一定温度下,在容积为1L的密闭容器中,存在如下关系:xH2O(g)  (H2O)x(g),反应物和生成物的物质的量随时间的变化关系如图。下列说法不正确的是
(H2O)x(g),反应物和生成物的物质的量随时间的变化关系如图。下列说法不正确的是
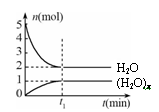
| A.x=3 |
| B.该温度下,反应的平衡常数为0.125 L2/mol2 |
| C.平衡时混合气体的平均摩尔质量是30 |
| D.t1时刻,保持温度不变,再充入1 molH2O(g), |
重新达到平衡时,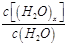
 将增大
将增大
25℃时,水的电离达到平衡:H2O H++OH―;ΔH>0,下列叙述正确的是
H++OH―;ΔH>0,下列叙述正确的是
| A.向水中加人稀氨水,平衡逆向移动,c(OH―)降低 |
| B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 |
| C.向水中加人少量固体NaCl,平衡逆向移动,c(H+)降低 |
| D.将水加热,Kw增大,pH不变 |
试题篮
()