下列事实中,不能用勒夏特列原理解释的是
| A.对熟石灰的悬浊液加热,悬浊液中固体质量增加 |
| B.实验室中常用排饱和食盐水的方式收集氯气 |
| C.打开汽水瓶,有气泡从溶液中冒出 |
| D.向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低 |
对于达到平衡状态的可逆反应:N2+3H2 2NH3 (正反应为放热反应)下列叙述中正确的是
2NH3 (正反应为放热反应)下列叙述中正确的是
| A.反应物和生成物的浓度相等 |
| B.反应物和生成物的浓度不再发生变化 |
| C.降低温度,平衡混合物里氨气的浓度减小 |
| D.增大压强,不利于氨的合成 |
在一定温度下,硫酸铜晶体的培养皿中存在下列平衡:Cu2+ +SO42-+x H2O CuSO4·xH2O,当向溶液中加少量无水硫酸铜粉末后,下列说法中正确的是
CuSO4·xH2O,当向溶液中加少量无水硫酸铜粉末后,下列说法中正确的是
| A.溶液中Cu2+浓度增大 | B.溶液中Cu2+数目增大 |
| C.该硫酸铜晶体体积不变 | D.溶液的蓝色不变 |
对于密闭容器中进行的反应CO(g) + H2O(g)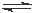 CO2 (g) +H2 (g),达到平衡后,其他条件不变,增大CO的浓度,下列说法不正确的是
CO2 (g) +H2 (g),达到平衡后,其他条件不变,增大CO的浓度,下列说法不正确的是
| A.正反应速率增大 |
| B.逆反应速率减小 |
| C.达到平衡时,逆反应速率比原平衡要大 |
| D.化学平衡常数不变 |
密闭的烧瓶里盛放气体A,在25℃时建立平衡:2A(g) B(g) ΔH<0,把烧瓶置于100℃的沸水中,在建立新平衡的过程中,烧瓶内混合气体的物理量始终不变的是
B(g) ΔH<0,把烧瓶置于100℃的沸水中,在建立新平衡的过程中,烧瓶内混合气体的物理量始终不变的是
| A.平均相对分子质量 | B.密度 | C.容器内的压强 | D.物质的量 |
下列有关颜色变化错误的是
| A.在4mL0.1mol/L的K2Cr2O7溶液中滴加数滴1mol/LNaOH溶液,溶液颜色从橙色变成黄色 |
| B.在试管中加入少量氯化钴晶体,滴加浓盐酸溶解后加水稀释至紫色,将试管置于热水中片刻,溶液颜色变成粉红色 |
| C.向血红色的Fe(SCN)3溶液中加入少量KI固体,溶液颜色变浅 |
| D.用50mL针筒抽取30mL红棕色的NO2气体并封住注射孔,当用力推压活塞,压缩针筒中的气体(此过程中不考虑温度变化),从针筒顶端观察,气体颜色先变深后变浅 |
在体积不变的密闭容器中按一定比例通入氮气和氢气,反应合成氨气,该反应放热。欲加快反应的速率同时提高合成氨中H2的转化率,下列措施可行的是( )
| A.升高温度 | B.适当增大压强 | C.加入催化剂 | D.从容器中分离出氨 |
若氧元素只有16O、18O两种核素,下列说法正确的是
| A.16O和18O的物理性质和化学性质完全相同 |
| B.通过化学反应可以实现16O与18O的相互转化 |
C.向2SO2(g)+ O2(g) 2SO3(g)的平衡体系中加入18O2,达到新的平衡后18O只出现在O2与SO3中 2SO3(g)的平衡体系中加入18O2,达到新的平衡后18O只出现在O2与SO3中 |
| D.用惰性电极电解含有H218O的普通水时,阳极可能产生三种相对分子质量不同的氧分子 |
吸热反应N2(g)+O2(g) 2NO(g),在2000℃时K=6.2×10-4。2000℃时,向10L密闭容器中放入3×10-3molNO、2.50×10-1molN2和4.00×10-2molO2。
2NO(g),在2000℃时K=6.2×10-4。2000℃时,向10L密闭容器中放入3×10-3molNO、2.50×10-1molN2和4.00×10-2molO2。
通过计算回答:
(1)此反应的初始状态是否为化学平衡状态?
(2)若非化学平衡状态,反应将向哪个方向进行以达到化学平衡状态?
t℃时,将3molA和1molB气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A(g)+B(g) xC(g).2min时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:
xC(g).2min时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)从反应开始至达到平衡状态,生成C的平均反应速率为 .
(2)x= ;平衡常数K= .
(3)若继续向原平衡混合物的容器中通入少量氦气(假设氦气和A、B、C都不反应)后,化学平衡(填字母) .
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
(4)若向原平衡混合物的容器中再充入amolC,在t℃时达到新的平衡,此时B的物质的量为n(B)= mol.
(5)如果上述反应在相同温度和容器中进行,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入三种物质的物质的量n(A)、n(B)、n(C)之间应该满足的关系式为 .
FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:
(1)FeCl3净水的原理是(用离子方程式表示) 。FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示) 。
(2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。
①若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1,c(Fe3+)=1.0×10-3mol·L-1,
c(Cl-)=5.3×10-2mol·L-1,则该溶液的PH约为 。
②完成NaClO3氧化FeCl2的离子方程式:
□ClO3―+□Fe2++□ =□Cl―+□Fe3++□ 。
(3)生成聚合氧化铁的离子方程式为:xFe3++yH2O Fex(OH)y(3x-y)++yH+ 欲使平衡正向移动可采用的方法是(填序号) 。
Fex(OH)y(3x-y)++yH+ 欲使平衡正向移动可采用的方法是(填序号) 。
a.降温 b.加水稀释 c.加入NH4Cl d.加入NaHCO3
一定温度下,在容积为1L的密闭容器中,存在如下关系:xH2O(g)  (H2O)x(g),反应物和生成物的物质的量随时间的变化关系如图。下列说法不正确的是
(H2O)x(g),反应物和生成物的物质的量随时间的变化关系如图。下列说法不正确的是
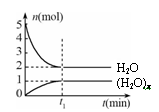
| A.x=3 |
| B.该温度下,反应的平衡常数为0.125 L2/mol2 |
| C.平衡时混合气体的平均摩尔质量是30 |
| D.t1时刻,保持温度不变,再充入1 molH2O(g), |
重新达到平衡时,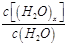
 将增大
将增大
25℃时,水的电离达到平衡:H2O H++OH―;ΔH>0,下列叙述正确的是
H++OH―;ΔH>0,下列叙述正确的是
| A.向水中加人稀氨水,平衡逆向移动,c(OH―)降低 |
| B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 |
| C.向水中加人少量固体NaCl,平衡逆向移动,c(H+)降低 |
| D.将水加热,Kw增大,pH不变 |
试题篮
()