将2molA与2molB混合于2L的密闭容器中发生如下反应:2A(g)+3B(g) 2C(g)+zD(g),2s后A的转化率为50%,测得v(D)=0.25mol•L-1•s-1,下列推断不正确的是( )
2C(g)+zD(g),2s后A的转化率为50%,测得v(D)=0.25mol•L-1•s-1,下列推断不正确的是( )
A.v(C)=v(D)=0.25mol•L-1•s-1 B.z=2
C.C的体积分数为28.6% D.B的转化率为25%
下列事实不能用勒夏特列原理来解释的是( )
| A.加压有利于SO2与O2反应生成SO3 |
| B.用过量氮气与氢气反应可以提高氢气的转化率 |
| C.将混合气中的氨气液化分离,有利于合成氨的反应 |
D.密闭容器中发生反应H2(g)+I2(g)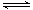 2HI (g),增大压强时容器中颜色加深 2HI (g),增大压强时容器中颜色加深 |
在其他条件不变时,下列说法正确的是( )
| A.增大压强一定会破坏气体反应的平衡状态 |
| B.升高温度可使化学平衡向放热的方向移动 |
| C.使用催化剂只能改变反应速率,不能改变化学平衡状态 |
| D.增大反应物浓度或减小生成物浓度,平衡向逆反应方向移动 |
对已经达到化学平衡状态的下列反应2X(g)+Y2(g) Z(g),减小压强时,对反应产生的影响是( )
Z(g),减小压强时,对反应产生的影响是( )
| A.v正、v逆都减小,平衡逆向移动 | B.v正、v逆都增大,平衡正向移动 |
| C.v逆增大,v正减小,平衡逆向移动 | D.v逆减小,v正增大,平衡正向移动 |
在一定温度下,可逆反应A(g)+3B(g)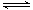 2C(g)达到平衡状态的标志是( )
2C(g)达到平衡状态的标志是( )
A.A、B、C的浓度相等
B.C的生成速率与C的分解速率相等
C.A、B、C的分子数目之比为1:3:2
D.单位时间内,生成1molA,同时生成3molB
在平衡2CrO42-(黄色)+2H+ Cr2O32-(橙红色)+H2O中,溶液介于黄色和橙红色之间,欲使溶液的橙红色加深,则要在溶液中加入( )
Cr2O32-(橙红色)+H2O中,溶液介于黄色和橙红色之间,欲使溶液的橙红色加深,则要在溶液中加入( )
| A.H+ | B.OH- | C.K+ | D.H2O |
体积恒定的密闭容器中,反应2SO2(g)+O2(g)  2SO3(g) △H<0,达平衡后,采用下列措施一段时间后,既能增大逆反应速率又能使平衡向正向移动的是( )
2SO3(g) △H<0,达平衡后,采用下列措施一段时间后,既能增大逆反应速率又能使平衡向正向移动的是( )
| A.移去SO3 | B.加入催化剂 | C.通入O2 | D.降低温度 |
下列有关研究化学反应原理的叙述中,正确的是
| A.研究化学反应中的能量变化,有利于通过改变反应条件,使同一反应消耗相同量的物质而放出更多的热,提高化学能的利用率 |
| B.任何放热的化学反应,均可以利用原电池直接把化学能转化为电能 |
| C.研究化学反应速率与化学平衡,有利于指导实际生产中达到“多,快,好,省”的生产效率 |
| D.使用催化剂常常可以加快化学反应速率,但不能提高反应物的转化率,因此在实际生产中较少使用催化剂 |
在一定温度下,将2 molA和2 molB两种气体相混合后于容积为2L的某密闭容器中,发生如下反应3A(g)+B(g) xC(g)+2D(g),2 min末反应达到化学平衡,生成了0.8 molD,并测得C的浓度为0.4 mol/L,请填写下列空白:
xC(g)+2D(g),2 min末反应达到化学平衡,生成了0.8 molD,并测得C的浓度为0.4 mol/L,请填写下列空白:
(1)x值等于_____________;
(2)A的转化率为 ;
(3)生成D的反应速率为 ;
(4)如果增大反应体系的压强,则平衡体系中C的质量分数将会 (填“增大”、“减小”或“不变”
一定温度下,在一固定体积的密闭容器中,可逆反应A(s)+3B(g) 2C(g)达到平衡时,下列说法正确的是
2C(g)达到平衡时,下列说法正确的是
①C的生成速率和C的分解速率相等; ②单位时间内生成a mol A,同时生成3a mol B;
③气体密度不再变化; ④混合气体的总压强不再变化;
⑤A、B、C的物质的量之比为1∶3∶2; ⑥混合气体的平均相对分子质量不变
A.②④⑤ B.①③④⑥ C.①②④⑥ D.①②③④⑤
已知2NO2 N2O4 + Q (Q﹥0),将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是
N2O4 + Q (Q﹥0),将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是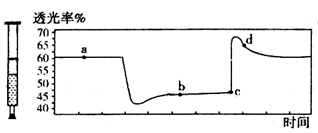
| A.c点的操作是拉伸注射器 |
| B.b点与a点相比,c(NO2)增大,c(N2O4)减小 |
| C.若反应在一绝热容器中进行,则a、b两点的平衡常数Ka>Kb |
D.d点: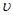 (正)> (正)> 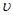 (逆) (逆) |
工业上用CO和H2生产燃料甲醇。一定条件下密闭容器中发生反应,测得数据曲线如下图所示(反应混合物均呈气态)。下列说法错误的是
A.反应的化学方程式:CO + 2H2  CH3OH CH3OH |
| B.反应进行至3分钟时,正、逆反应速率相等 |
| C.反应至10分钟,ʋ(CO) =" 0.075" mol/L·min |
| D.增大压强,平衡正向移动,K增大 |
在恒容密闭容器中进行氢气与碘(气态)合成HI的反应,下列说法能表明反应达到平衡的是
| A.气体的平均分子量不再变化 | B.反应的平衡常数不变 |
| C.ʋ(H2) =" 2" ʋ(HI) | D.气体的颜色不再变化 |
一定温度下,在固定容积的密闭容器中,发生可逆反应2A(g)+3B(s) 2C(g),下列叙述不是达到平衡的标志的是( )
2C(g),下列叙述不是达到平衡的标志的是( )
①单位时间生成a mol A,同时消耗1.5a mol B
②C的生成速率与C的分解速率相等
③各组分的浓度不再变化
④混合气体的密度不再变化
⑤混合气体的总压强不再变化
⑥A、B、C的分子数目比为2:3:2
⑦混合气体的平均摩尔质量不再变化
⑧混合气体的物质的量不再变化
A.④⑥⑦ B.⑤⑥⑧ C. ①③④ D.①⑤⑧
试题篮
()