可逆反应aA(g)+bB(g)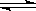 cC(g)+dD(g);ΔH同时符合下列两图中各曲线的规律的是( )
cC(g)+dD(g);ΔH同时符合下列两图中各曲线的规律的是( )
| A.a+b>c+d T1<T2 ΔH<0 | B.a+b>c+d T1<T2 ΔH>0 |
| C.a+b<c+d T1>T2 ΔH<0 | D.a+b>c+d T1>T2 ΔH>0 |
在密闭容器中,加入3mol A和1mol B,一定条件下发生反应
3A(g)+B(g) 2C(g)+D(g),达平衡时,测得C的浓度为w mol/L,若保持体积和温度不变,重新按下列配比作起始物质,达到平衡时,C的浓度仍然为w mol/L的是( )
2C(g)+D(g),达平衡时,测得C的浓度为w mol/L,若保持体积和温度不变,重新按下列配比作起始物质,达到平衡时,C的浓度仍然为w mol/L的是( )
| A.6mol A+2mol B |
| B.1.5mol A+0.5mol B+1mol C+0.5mol D |
| C.3mol A+1mol B+2mol C+1mol D |
| D.4mol C+1mol D |
下列有关实验装置进行的相应实验,能达到实验目的的是( )
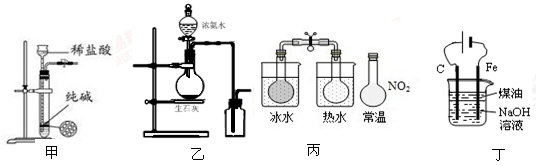
| A.用图甲所示装置控制制取少量的CO2气体 |
| B.用图乙所示装置制取并收集氨气 |
C.用图丙所示装置可以说明反应2NO2(g) N2O4(g)是放热反应 N2O4(g)是放热反应 |
| D.用图丁所示装置可制备Fe(OH)2并能较长时间观察其颜色 |
向某恒容密闭容器中充入一定量CO2和H2,发生反应:CO2(g)+H2(g) HCOOH(g)
HCOOH(g)
测得平衡体系中CO2的百分含量(CO2%)与反应温度变化的关系如图所示。下列物理量中,a点大于b点的是 ①正反应速率②逆反应速率③HCOOH(g)的浓度④对应温度时的平衡常数

| A.①② | B.①③ | C.②④ | D.③④ |
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g)  2NH3(g) ΔH=-92.6 kJ·mol-1。实验测得起始、平衡时的有关数据如表所示:
2NH3(g) ΔH=-92.6 kJ·mol-1。实验测得起始、平衡时的有关数据如表所示:
| 容器 编号 |
起始时各物质的物质的量/mol |
达到平衡时体 系能量的变化 |
||
| N2 |
H2 |
NH3 |
||
| ① |
1 |
3 |
0 |
放出能量:23.15 kJ |
| ② |
0.9 |
2.7 |
0.2 |
放出热量:Q |
下列叙述错误的是( )
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数均为
C.容器②中达到平衡时N2的转化率为25%
D.若容器①体积为0.5 L,则平衡时放出的热量<23.15 kJ
在容积不变的密闭容器中进行反应:
2SO2(g)+O2(g) 2SO3(g) △H<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是
2SO3(g) △H<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是
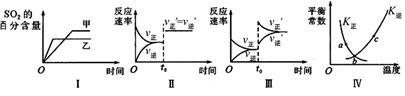
| A.图I表示温度对化学平衡的影响,且甲的温度较高 |
| B.图Ⅱ表示t0时刻使用催化剂对反应速率的影响 |
| C.图Ⅲ表示t0时刻增大O2的浓度对反应速率的影响 |
| D.图Ⅳ中a、b、c三点中只有b点已经达到化学平衡状态 |
草酸(H2C2O4)是一种二元弱酸,广泛分布于动植物体中。
(1)人体内草酸累积过多是导致结石(主要成分是草酸钙)形成的原因之一。有研究发现,EDTA(一种能结合金属离子的试剂)在一定条件下可以有效溶解结石,用化学平衡原理解释其原因: 。
(2)已知:0.1 mol·L-1KHC2O4溶液呈酸性。下列说法正确的是 (填字母序号)。
a. 0.1 mol·L-1KHC2O4溶液中:c(K+) + c(H+) = c(HC2O4-) + 2c(C2O42-) + c(OH-)
b. 0.1 mol·L-1 KHC2O4溶液中:c(K+) > c(HC2O4-) > c(C2O42-) > c(H2C2O4)
c. 浓度均为0.1 mol·L-1 KHC2O4和K2C2O4的混合溶液中:2c(K+) = c(HC2O4-) + c(C2O42-)
d. 0.1 mol/L KHC2O4溶液中滴加等浓度NaOH溶液至中性:c(K+) > c(Na+)
(3)利用草酸制备草酸亚铁晶体(FeC2O4·xH2O)的流程及组分测定方法如下:
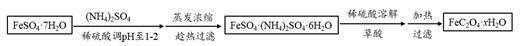
已知:i. pH>4时,Fe2+易被氧气氧化
ii. 几种物质的溶解度(g /100g H2O)如下
| |
FeSO4·7H2O |
(NH4)2SO4 |
FeSO4·(NH4)2SO4·6H2O |
| 20℃ |
48 |
75 |
37 |
| 60℃ |
101 |
88 |
38 |
①用稀硫酸调溶液pH至1~2的目的是: , 。
②趁热过滤的原因是: 。
③氧化还原滴定法常用于测定草酸亚铁晶体的摩尔质量(M)。称取a g草酸亚铁晶体溶于稀硫酸中,用b mol·L-1的高锰酸钾标准液滴定,到达滴定终点时,消耗高锰酸钾VmL,则M = 。(已知:部分反应产物为Mn2+、Fe3+、CO2)
己知某密闭容器中发生反应:X(g)+Y(g)=2W(g)+Z(g) △H<0(Y物质易被液化)。下列有关说法中一定正确的是
| A.若W为有颜色的物质,达到平衡后,增大压强,体系颜色变浅 |
| B.平衡时其它条件不变,升高温度,正反应速率增大程度比逆反应率增大程度小 |
| C.平衡时,其它条件不变,分离出Z,正反应速率加快 |
| D.若在原电池中进行,反应放出的热量不变 |
5L容器中充入2molA(g)和1molB(g),在一定条件下发生反应: 2A(g)+B(g) 2C(g),达平衡时,在相同温度下测得容器内混合气体压强是反应前的5/6,则A的转化率为( )
2C(g),达平衡时,在相同温度下测得容器内混合气体压强是反应前的5/6,则A的转化率为( )
| A.67% | B.50% | C.25% | D.5% |
在已经处于化学平衡状态的体系中,如果下列量发生变化其中一定能表明平衡移动的是( )
| A.反应物的转化率 | B.反应混和物的浓度 |
| C.正、逆反应速率 | D.反应混和物的压强 |
在恒容的密闭容器中进行的可逆反应A(g)+3B(g) 2C(g)达到平衡的标志是( )
2C(g)达到平衡的标志是( )
| A.C生成的速率和C分解的速率相等 |
| B.单位时间内生成n molA,同时生成3n molB |
| C.B的消耗速率与C的消耗速率之比为1∶1 |
| D.混合气体密度保持不变 |
下列事实不能用平衡移动原理解释的是
| A.配制FeCl3溶液时加入少量的浓盐酸 |
| B.常温下,NaOH溶液中由水电离出的c(H+)<1×10-7mol/L |
| C.AgCl在水中的溶解度大于在饱和NaCl溶液中的溶解度 |
| D.工业上SO2转化为SO3用五氧化二钒铁触媒作为催化剂 |
下列说法正确的是( )
| A.常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)能自发进行,则△H<0 |
| B.铁片镀锌时,铁片与外电源的正极相连 |
| C.以熔融NaCl为电解质进行电解冶炼钠,熔融体中Na+向阳极移动 |
D.t℃时,恒容密闭容器中反应:NO2(g)+SO2(g) NO(g)+SO3(g),通入少量O2, NO(g)+SO3(g),通入少量O2,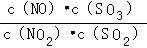 的值及SO2转化率不变 的值及SO2转化率不变 |
试题篮
()