根据下列实验现象,所得结论错误的是
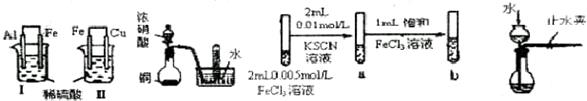
| 实验 |
实验现象 |
结论 |
| A |
Ⅰ烧杯中铁片表面有气泡,Ⅱ烧杯中铜片表面有气泡 |
活动性Al>Fe>Cu |
| B |
试管中收集到无色气体 |
铜与浓硝酸反应产物是NO |
| C |
试管b比试管a中溶液的红色深 |
增大反应物浓度,平衡向正反应方向移动 |
| D |
长颈漏斗内液面高于烧瓶内液面且保持不变 |
装置气密性良好 |
向某恒容密闭容器中充入一定量C02和H2,发生反应: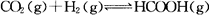 测得平衡体系中C02的百分含量(C02%)与反应温度变化的关系如图所示。下列物理量 中,a点大于b点的是
测得平衡体系中C02的百分含量(C02%)与反应温度变化的关系如图所示。下列物理量 中,a点大于b点的是

①:正反应速率 ②逆反应速率 ③HCOOH(g)的浓度 ④对应温度时的平衡常数
| A.①② | B.①③ | C.②④ | D.③④ |
合成氨反应:N2(g)+3H2(g) 2NH3(g)ΔH="-92.4" kJ·mol-1,在反应过程中,正反应速率的变化如图所示:
2NH3(g)ΔH="-92.4" kJ·mol-1,在反应过程中,正反应速率的变化如图所示:
下列说法正确的是
| A.t1时升高了温度 | B.t2时使用了催化剂 |
| C.t3时增大了压强 | D.t4时降低了温度 |
在一定温度下的定容容器中,发生反应:2A(g)+B(s) C(g)+D(g),下列描述中能表明反应已达到平衡状态的是
C(g)+D(g),下列描述中能表明反应已达到平衡状态的是
①混合气体的压强不变
②混合气体的密度不变
③C(g)的物质的量浓度不变
④容器内A、C、D三种气体的浓度之比为2:1:1
⑤单位时间内生成n molD,同时生成2n mol A.
⑥单位时间内生成n molC,同时消耗n mol D.
A.①②③ B.③④⑥ C.②③⑤⑥ D.只有 ③
现有下列两个图象:下列反应中符合上述图象的是
A.N2(g)+3H2(g) 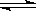 2NH3(g) ΔH<0 2NH3(g) ΔH<0 |
B.2SO3(g) 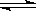 2SO2(g)+O2(g) ΔH>0 2SO2(g)+O2(g) ΔH>0 |
C.4NH3(g)+5O2(g) 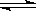 4NO(g)+6H2O(g) ΔH<0 4NO(g)+6H2O(g) ΔH<0 |
D.H2(g)+CO(g) 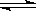 C(s)+H2O(g) ΔH>0 C(s)+H2O(g) ΔH>0 |
某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+ 3B2(g)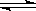 2AB3(g)化学平衡状态的影响,得到如下图所示的曲线(图中T表示温度,n表示物质的量)下列判断正确的是
2AB3(g)化学平衡状态的影响,得到如下图所示的曲线(图中T表示温度,n表示物质的量)下列判断正确的是
A.若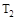 > >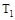 ,则正反应是放热反应 ,则正反应是放热反应 |
B.达到平衡时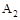 的转化率大小为:b>a>c 的转化率大小为:b>a>c |
C.若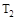 > >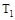 ,达到平衡时b、d点的反应速率为 ,达到平衡时b、d点的反应速率为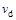 > >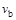 |
D.在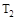 和 和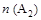 不变时达到平衡, 不变时达到平衡,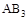 的物质的量大小为:c>b>a 的物质的量大小为:c>b>a |
只改变一个影响因素,平衡常数K与化学平衡移动的关系叙述错误的是
| A.K值不变,平衡可能移动 | B.K值变化,平衡一定移动 |
| C.平衡移动,K值可能不变 | D.平衡移动,K值一定变化 |
在密闭容器中进行下列反应:M (g)+N (g)  R (g)+2 L此反应符合下面图像。下列叙述正确的是
R (g)+2 L此反应符合下面图像。下列叙述正确的是
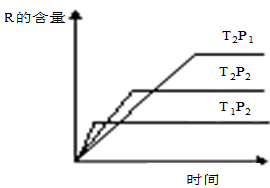
| A.正反应放热,L是气体 |
| B.正反应吸热,L是固体 |
| C.正反应吸热,L是气体 |
| D.正反应放热,L是液体 |
常温常压下,在带有相同质量活塞的容积相等的甲、乙两容器里,分别充有二氧化氮(甲)和空气(乙),现分别进行下列两项实验:
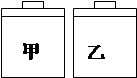
(N2O4 2NO2 △H> 0)
2NO2 △H> 0)
(a)将两容器置于沸水中加热 (b)在活塞上都加2 kg的砝码
在以上两情况下,甲和乙容器的体积大小的比较,正确的是
| A.(a)甲>乙,(b)甲>乙 | B.(a)甲>乙,(b)甲=乙 |
| C.(a)甲<乙,(b)甲>乙 | D.(a)甲>乙,(b)甲<乙 |
下列叙述中,不能用平衡移动原理解释的是
| A.红棕色的NO2,加压后颜色先变深后变浅 |
| B.高压比常压有利于合成SO3的反应 |
| C.由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深 |
| D.黄绿色的氯水光照后颜色变浅 |
(1)①1 g 硫粉在O2中充分燃烧放出 a kJ热量,写出硫燃烧的热化学方程式 。
②已知25℃时,C2H5OH(l)的燃烧热为1366.8kJ/mol,用热化学方程式表示:
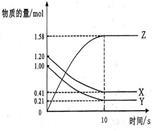
(2)一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线图如下图示,则①在10S内Z的平均速率为 ②该反应的化学方程式 。
可逆反应:3A(g)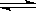 3B(?)+C(?)(正反应为吸热反应),随着温度升高,气体平均相对分子质量有变小的趋势,则下列判断正确的是
3B(?)+C(?)(正反应为吸热反应),随着温度升高,气体平均相对分子质量有变小的趋势,则下列判断正确的是
| A.若C为固体,则B一定是气体 | B.B和C一定都是气体 |
| C.B和C可能都是固体 | D.B和C不可能都是气体 |
在容积为2L的密闭容器中进行反应:CO(g)+2H2(g) CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图所示,下列说法正确的是
CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图所示,下列说法正确的是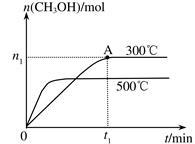
| A.该反应的△H>0 |
| B.其他条件不变,升高温度反应的平衡常数增大 |
| C.300℃时,0-t1min内 CH3OH的平均生成速率为n1/2t1 mol·L-1 min-1 |
| D.A点的反应体系从300℃升高到500℃,达到平衡时n(H2)/n(CH3OH)减小 |
如图所示曲线表示其他条件一定时,反应:2NO+O2 2NO2 ΔH<0,NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是
2NO2 ΔH<0,NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是
| A.a点 | B.b点 |
| C.c点 | D.d点 |
试题篮
()