肼(N2H4)与N2O4,是火箭发射中最常用的燃料与助燃剂。
(1)已知2N2H4(l)+ N2O4(l)= 3N2(g) +4H2O(l) △H=-1225KJ/mol

则使1 mol N2O4(l)完全分解成相应的原子时需要吸收的能量是 。
(2)800℃时,某密闭容器中存在如下反应:2NO2(g)  2NO(g) +O2(g) △H>0,若开始向容器中加入1 mol/L的NO2,反应过程中NO的产率随时间的变化如下图曲线I所示。
2NO(g) +O2(g) △H>0,若开始向容器中加入1 mol/L的NO2,反应过程中NO的产率随时间的变化如下图曲线I所示。

①反应Ⅱ相对于反应I而言,改变的条件可能是 。
②请在图中绘制出在其它条件与反应I相同时,反应在820℃时进行,NO的产率随时间的变化曲线。
③800℃时,若开始时向容器中同时加入1 mol/L NO、0.2 mol/L O2、0.5 mol/L NO2,则v(正) v(逆)。
(3)己知N2O4(g)  2NO2(g) △H=+57.20kJ/mol,t时,将一定量的NO2、N2O4,充人一个容器为2L的恒容密闭容器中,浓度随时间变化关系如下表所示:
2NO2(g) △H=+57.20kJ/mol,t时,将一定量的NO2、N2O4,充人一个容器为2L的恒容密闭容器中,浓度随时间变化关系如下表所示:

①c( X)代表 (填化学式)的浓度,该反应的平衡常数K= 。
②前10 min内用NO2表示的反应速率为 ,20 min时改变的条件是 ;重新达到平衡时,NO2的百分含量 (填选项前字母)。
a.增大 b.减小 c.不变 d.无法判断
(本题共7分)将一定量的A、B、C三种物质(都是气体)放入固定体积为10 L的密闭容器中,一定条件下发生反应,一段时间内测得各物质的物质的量变化如下图所示。请解答下列问题:
(1)反应的化学方程式用A、B、C可表示为 。
(2)用B的浓度变化表示在0~10 min内的反应速率是 。
(3)在该条件达到反应的限度(平衡状态)时反应物的转化率(转化率==转化的物质的量/初始物质的量 ×100%,计算结果保留1位小数)
葡萄酒中抗氧化剂的残留量是以游离SO2的含量计算,我国国家标准(GB2760-2014)规定葡萄酒中SO2的残留量≤0.25g/L。某兴趣小组设计实验方案对葡萄酒中SO2进行测定。
Ⅰ.定性实验方案如下:
(1)将SO2通入水中形成SO2 ─饱和H2SO3溶液体系,此体系中存在多个含硫元素的平衡,分别用平衡方程式表示为_______________。
(2)利用SO2的漂白性检测干白葡萄酒(液体为无色)中的SO2或H2SO3。设计如下实验:
实验结论:干白葡萄酒不能使品红溶液褪色,原因为:_________________________。
Ⅱ.定量实验方案如下(部分装置和操作略):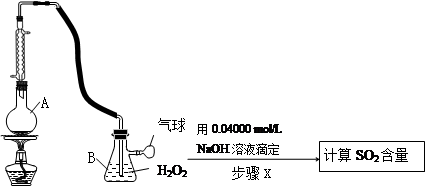
(3)仪器A的名称是________________。
(4)A中加入100.0mL葡萄酒和适量盐酸,加热使SO2全部逸出并与B中H2O2完全反应,其化学方程式为______________。
(5)除去B中过量的H2O2,然后再用NaOH标准溶液进行滴定, 除去H2O2的方法是__________。
(6)步骤X滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2的含量为__________g/L。该测定结果比实际值偏高,分析原因________________________。
如图所示,向A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,起始时,V(A)=V(B)=a L。在相同温度和有催化剂存在的条件下,两容器中各自发生下述反应:
X+Y 2Z+W △H<0(X、Y、Z、W均为气体),
2Z+W △H<0(X、Y、Z、W均为气体),
达到平衡时,V(A)=1.2aL,试回答:
(1)A中X的转化率α(A)=________;
(2)A、B中X转化率的关系:α(A)_________ α(B)(填“>”、“=”“<”);
(3)打开K,一段时间又达到平衡时,A的体积为_______L(连通管中气体体积不计)
(14分) 二氧化碳与氢气催化合成甲醇,发生的反应为:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
(1)已知:
| 化学键 |
H-H |
C-O |
C=O |
H-O |
C-H |
| 键能/kJ·mol-1 |
436 |
326 |
803 |
464 |
414 |
计算上述反应的△H= kJ.mol-1。
(2)一定条件下,将n(CO2):n(H2)=1:1的混合气充入恒温恒容密闭容器中,下列事实可以说明该反应已达平衡的是 (填选项字母)。
A.容器内气体密度保持不变
B.CO2的体积分数保持不变
C.H2O(g)与CO2(g)的生成速率之比为1∶1
D.该反应的平衡常数保持不变
E.混合气体的平均相对分子质量不变
F.容器中压强保持不变
(3)一定条件下,往2L恒容密闭容器中充入1.2molCO2和3.6molH2,在不同催化剂作用下的反应I、反应II与反应III,相同时间内CO2转化率随温度变化的数据如表所示,据表中数据绘制“图1”:
| 相同时间内CO2转化率 |
T1 |
T2 |
T3 |
T4 |
T5 |
| 反应Ⅰ |
65% |
77% |
80% |
80% |
66.67% |
| 反应Ⅱ |
56% |
67% |
76% |
80% |
66.67% |
| 反应Ⅲ |
48% |
62% |
72% |
80% |
66.67% |

(T5时,图1中C点转化率为66.67%,即转化了2/3)
①催化剂效果最佳的反应是 (填“反应I”,“反应II”,“反应III”)。
②T3的b点v(正) v(逆)(填 “>”, “<”, “="”" )。
③T4的a点转化率比T5的c点高的原因是 。
④在温度为T5时,该反应的平衡常数K= 。
⑤在温度为T5时,CH3OH的浓度随时间变化的趋势如“图2”所示。
当时间到达t1时,将生成的甲醇和水同时除去,并维持该温度,在 t2时达新平衡。
请在“图2”中画出t1时刻后CH3OH的浓度变化总趋势曲线。
在一定条件下,将2molA和2molB混合于容积为2L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(g)。2min末反应达到平衡状态时,生成0.8molD,同时测得C的浓度为0.4mol/L。请填写下列空白:
xC(g)+2D(g)。2min末反应达到平衡状态时,生成0.8molD,同时测得C的浓度为0.4mol/L。请填写下列空白:
(1)x=______;用D的浓度变化表示的化学反应速率为_____________。
(2)A的平衡浓度为_______,B的转化率为__________。
(3)如果增大体系的压强,则平衡体系中C的体积分数将____(填“增大”“减小”或“不变”)。
(4)如果上述反应在相同条件下从逆反应开始进行,起始时加入C和D各 mol,要使平衡时各物质的体积分数与原平衡时完全相同,则还应加入______物质________mol。
mol,要使平衡时各物质的体积分数与原平衡时完全相同,则还应加入______物质________mol。
汽车尾气作为空气污染的主要来源之一,其中含有大量的有害物质,包括CO、NOx、碳氢化合物和固体悬浮颗粒等。对汽车尾气的治理使环境工作者面临了巨大的挑战。试回答下列问题:
(1)用CH4催化还原NOx可以消除氮氧化物的污染。已知:
①CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
②CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
则由CH4将NO2完成还原成N2,生成CO2和水蒸气的热化学方程式是____________________;
(2)NOx也可被NaOH溶液吸收而生成NaNO3、NaNO2,已知某温度下,HNO2的电离常数Ka=9.7×10-4mol•L-1,NO2-的水解常数为Kh=8.0×10-10mol•L-1,则该温度下水的离子积常数=______(用含Ka、Kh的代数式表示),此时溶液的温度______25℃(“>”、“<”、“=”)。
(3)化工上利用CO合成甲醇,反应的热化学方程式为:CO(g)+2H2(g)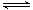 CH3OH(g)△H=-90.8KJ•mol-1。不同温度下,CO的平衡转化率如右图所示:图中T1、T2、T3的高低顺序是________,理由是______。
CH3OH(g)△H=-90.8KJ•mol-1。不同温度下,CO的平衡转化率如右图所示:图中T1、T2、T3的高低顺序是________,理由是______。
(4)化工上还可以利用CH3OH生成CH3OCH3。在体积均为1.0L的恒容密闭容器中发生反应:2CH3OH(g)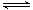 CH3OCH3(g)+H2O(g)。
CH3OCH3(g)+H2O(g)。
| 容器编号 |
温度(℃) |
起始物质的量(mol) |
平衡物质的量(mol) |
|
| CH3OH |
CH3OCH3 |
H2O |
||
| Ⅰ |
387 |
0.20 |
0.080 |
0.080 |
| Ⅱ |
207 |
0.20 |
0.090 |
0.090 |
该反应的正反应为________反应(填“吸热”、“放热”),若起始是向容器Ⅰ中充入CH3OH0.15mol、CH3OCH30.15mol和H2O0.10mol,则反应将向_____方向进行(填“正”、“逆”)。
(5)CH3OH燃料电池在便携式通讯设备、汽车等领域有着广泛的应用。已知电池工作时的总反应方程式为:2CH3OH+3O2=2CO2+4H2O,电池工作时的示意图如右图所示: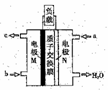
质子穿过交换膜移向_____电极区(填“M”、“N”),负极的电极反应式为________。
(14分)请回答下列问题:
(1)下表列出了一些化学键的键能E:
| 化学键 |
H—H |
O===O |
O—H |
| E/kJ·mol-1 |
436 |
x |
463 |
反应H2(g)+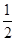 O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1,则x=__________。
O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1,则x=__________。
(2)铅蓄电池是正极板上覆盖有PbO2,负极板上覆盖有Pb,电解质溶液是H2SO4溶液,电池放电时的总反应:Pb+PbO2+2H2SO4=2PbSO4+2H2O。
请写出充电时阴极的电极反应式:__________________
(3)反应m A+n B p C,在某温度下达到平衡。
p C,在某温度下达到平衡。
①若A、B、C都是气体,减压后正反应速率小于逆反应速率,则m、n、p的关系是________________。
②若C为气体,且m + n = p,在加压时化学平衡发生移动,则平衡必定向________________方向移动。
③若再升高温度,平衡向逆向移动,则正反应为 _________ 反应(填“吸热”或“放热”)
(4)依据氧化还原反应Zn(s)+Cu2+(aq)===Zn2+(aq)+Cu(s)设计的原电池如图所示。

①请在图中标出电极材料及电解质溶液(写化学式)________________
②盐桥中的Cl-向________极移动(填“左”或“右”)。
“洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了高热值的煤炭气,其主要成分是CO和H2。CO和H2可作为能源和化工原料,应用十分广泛.生产煤炭气的反应之一是:C(s)+H2O(g) CO(g)+H2(g) H=+131.4kJ/mol
CO(g)+H2(g) H=+131.4kJ/mol
(1)在容积为3L的密闭容器中发生上述反应,5min后容器内气体的密度增大了0.12g/L,用H2O表示0~5min的平均反应速率为______________。
(2)关于上述反应在化学平衡状态时的描述正确的是___________.
A.CO的含量保持不变
B.v正(H2O)=v正(H2)
C.容器中混合气体的平均相对分子质量保持不变
(3)若上述反应在t0时刻达到平衡(如图),在t1时刻改变某一条件,请在图中继续画出t1时刻之后正反应速率随时间的变化:
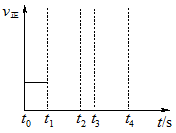
①缩小容器体积,t2时到达平衡(用实线表示);
②t3时平衡常数K值变大,t4到达平衡(用虚线表示).
(4)在一定条件下用CO和H2可以制得甲醇,CH3OH和CO的燃烧热分别为725.8kJ/mol,283.0kJ/mol,1molH2O(l)变为H2O(g)吸收44.0 kJ的热量,写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式_______________________
(5)如下图所示,以甲醇燃料电池作为电源实现下列电解过程.乙池中发生反应的离子方程式为_____________。当甲池中增重16g时,丙池中理论上产生沉淀质量的最大值为_________g。
在20L的密闭容器中按物质的量之比1:2充入CO和H2,发生:CO(g)+2H2(g) CH3OH(g)△H。测得平衡时CO的转化率随温度及不同压强下的变化。P2和195℃时n(H2)随时间的变化结果如表格所示。下列说法正确的是
CH3OH(g)△H。测得平衡时CO的转化率随温度及不同压强下的变化。P2和195℃时n(H2)随时间的变化结果如表格所示。下列说法正确的是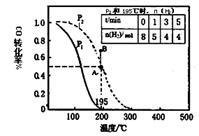
| A.0~3 min,平均速率v(CH3OH)="0.8" mol•L-1•min-1 |
| B.P1<P2,△H<0 |
| C.在P2及195℃时,该反应的平衡常数为25 |
| D.在B点时,v(正)>v(逆) |
大气污染越来越成为人们关注的问题,烟气中的NOx必须脱除(即脱硝)后才能排放。
(1)已知:CH4(g)+2O2(g)===CO2(g)+2H2O(1) ΔH=-890.3 kJ·mol-1
N2(g)+O2(g)==="2NO(g)" ΔH=+180 kJ·mol-1
CH4可用于脱硝,其热化学方程式为:CH4(g)+4NO(g)=CO2(g)+2N2(g)+2H2O(1),ΔH=________。
(2)C2H4也可用于烟气脱硝。为研究温度、催化剂中Cu2+负载量对NO去除率的影响,控制其它条件一定,实验结果如图1所示。为达到最高的NO去除率,应选择的反应温度和Cu2+负载量分别是___________________________。

(3)臭氧也可用于烟气脱硝。
①O3氧化NO 结合水洗可产生HNO3和O2,该反应的化学方程式为______________。
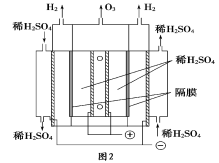
②一种臭氧发生装置原理如图2所示。阳极(惰性电极)的电极反应式为___________。
(4)如图3是一种用NH3脱除烟气中NO的原理。

①该脱硝原理中,NO最终转化为________(填化学式)和H2O。
②当消耗2molNH3和0.5molO2时,除去的NO在标准状况下的体积为_____________。
(5)NO直接催化分解(生成N2与O2)也是一种脱硝途径。在不同条件下,NO的分解产物不同。在高压下,NO在40 ℃下分解生成两种化合物,体系中各组分物质的量随时间变化曲线如图4所示。写出Y和Z的化学式: _____________________________。
在体积均为1.0L的两个恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+C(s) 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是( )
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是( )

A.反应CO2(g)+c(s) 2CO(g) △S>0、△H<0 2CO(g) △S>0、△H<0 |
| B.体系的总压强P总:P总(状态Ⅱ)>2P总(状态Ⅰ) |
| C.体系中c(CO):c(CO,状态Ⅱ) >2c(CO,状态Ⅲ) |
| D.逆反应速率V逆:V逆(状态Ⅰ)>V逆(状态Ⅲ) |
运用化学反应原理研究部分单质及其化合物的反应有重要意义。
 (1)氨是氮循环过程中的重要物质,是氮肥工业的重要原料。氨的合成目前普遍使用的人工固氮方法:N2(g)+3H2(g)
(1)氨是氮循环过程中的重要物质,是氮肥工业的重要原料。氨的合成目前普遍使用的人工固氮方法:N2(g)+3H2(g)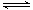 2NH3(g)。请回答:
2NH3(g)。请回答:
①已知:H-H键能为436kJ/mol,N N键能为945kJ/mol,N一H键能为391kJ/mol.由键能计算消耗1molN2时的△H=_________。若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡_______移动(填“向左”、“向右”或“不”);
②如图中:当温度由T1变化到T2时,KA______KB(填“>”、“<”或“=”)。
(2)氨气溶于水得到氨水。NO2可用氨水吸收生成NH4NO3,25℃时,将amolNH4NO3溶于水,溶液显酸性,原因是___________(用离子方程式表示),向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将__________(填“正向”、“不”或“逆向”)移动,所滴加氨水的浓度为________mol/L(用含a、b的代数式表示),(NH3·H2O的电离平衡常数取Kb=2×10-5mol/L)
(3)硫酸生产中,SO2催化氧化生成SO3:SO2(g)+1/2O2(g)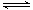 SO3(g)△H<0,是工业上生产硫酸的关键步骤。
SO3(g)△H<0,是工业上生产硫酸的关键步骤。
①在某温度时,该反应的平衡常数K=0.75,若在此温度下,向100L的恒容密闭容器中,充入3mol SO2、4mol O2和4mol SO3,则反应开始时正反应速率________逆反应速率(填“<”、“>”或“=”)。
②在①中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是________。
a.保持温度和容器体积不变,充入1.0mol SO3(g)
b.保持温度和容器内压强不变,充入2.0mol He
c.降低温度
d.在其他条件不变时,减小容器的容积
③由硫酸可制得硫酸盐.在一定温度下,向K2SO4溶液中滴加Na2CO3溶液和BaCl2溶液,当两种 沉淀共存时,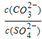 =_________。
=_________。
[已知该温度时,Ksp(BaSO4)=1.3×10-10,Ksp(BaCO3)=5.2×10-9]
在3个2 L的密闭容器中,在相同的温度下、使用相同的催化剂分别进行反应:3H2(g)+N2(g)  2NH3(g)。按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
2NH3(g)。按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下: 
下列说法不正确的是( )
| A.容器乙中反应从开始到达平衡的反应速率为v(H2)=0.3mol·L-1·min-1 |
| B.2c1<1.5 |
C.在该温度下甲容器中反应的平衡常数K= |
| D.2ρ1=ρ2 |
运用化学反应原理研究氮、硫等单质及其化合物的反应有重要意义。
(1)硫酸生产过程中2SO2(g)+O2(g) 2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如图所示,根据下图回答下列问题:
2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如图所示,根据下图回答下列问题:

①2SO2(g)+O2(g) 2SO3(g)的△H______0(填“>”或“<”)。
2SO3(g)的△H______0(填“>”或“<”)。
②一定条件下,将SO2与O2以体积比2:1置于一体积不变的密闭容器中发生以上反应,能说明该反应已达到平衡的是___________(填字母编号)。
a.体系的密度不发生变化
b.SO2与SO3的体积比保持不变
c.体系中硫元素的质量百分含量不再变化
d.单位时间内转移4 mol 电子,同时消耗2 mol SO3
e.容器内的气体分子总数不再变化
(2)一定的条件下,合成氨反应为:N2(g)+3H2(g) 2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。

①该反应的平衡常数表达式为 ,升高温度,平衡常数 (填“增大”或“减小”或“不变”)。
②由图2信息,计算0~10min内该反应的平均速率v(H2)= ,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为 (填“a”或“b”或“c”或“d”)。
③图3 a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是 点,温度T1 T2(填“>”或“=”或“<”)
(3)若将等物质的量的SO2与NH3溶于水充分反应,所得溶液呈 性,所得溶液中c(H+)- c(OH-)= (填写表达式)(已知:H2SO3:Ka1=1.7×10-2,Ka2=6.0×10-8,NH3·H2O:Kb=1.8×10-5)。
试题篮
()