(14分)氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题: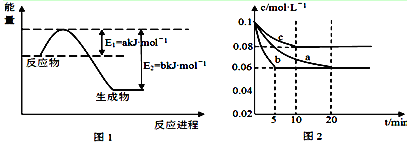
(1)图1是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图(a、b均大 于0),且已知: 2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-c kJ·mol-1(c>0),请写出CO将NO2还原至N2时的热化学方程式 ;
(2)图2是实验室在三个不同条件的密闭容器中合成氨时,N2的浓度随时间的变化曲线(以a、b、c表示)。已知三个条件下起始加入浓度均为:c(N2)=0.1mol·L-1, c(H2)=0.3mol·L-1;
合成氨的反应:N2(g)+3H2(g) 2NH3(g) △H< 0
2NH3(g) △H< 0
①计算在a达平衡时H2的转化率为 ;
②由图2可知,b、c各有一个条件与a不同,则c的条件改变可能是 ; 试写出判断b与a条件不同的理由 ;
(3)利用图2中c条件下合成氨(容积固定)。已知化学平衡常数K与温度(T)的关系如 下表:
| T/(K) |
298 |
398 |
498 |
…… |
| K |
4.1×106 |
K1 |
K2 |
…… |
①试确定K1的相对大小,K 1 4.1× 106(填写“>”“=”或“<”)
②下列各项能作为判断该反应达到化学平衡状态的依据的是 (填序号字母)。
A.容器内NH3的浓度保持不变 B.2υ( N2)正= υ( H2)逆
C.容器内压强保持不变 D.混合气体的密度保持不变
(4)①NH4Cl溶液呈酸性的原因是(用离子反应方程式表示 ) 。
②25℃时,将pH =x氨水与pH =y的硫酸(且x + y =" 14," x > 11 )等体积混合后,所得溶液中各种离子的浓度关系正确的是
A.c(SO42-)>c(NH4+)>c(H+)>c(OH-) B.c(NH4+)>c(SO42-)>c(OH-)>c(H+)
C.c(NH4+)+c(H+)>c(SO42-)+c(OH-) D.c(NH4+)>c(SO42-)>c(H+)>c(OH-)
【化学—选修2:化学与技术】
I、污水经过一级、二级处理后,还含有少量Cu2+、Hg2+、Pb2+等重金属离子,可加入沉淀剂使其沉淀。下列物质不能作为沉淀剂的是
| A.氨水 | B.硫化氢气体 | C.硫酸钠溶液 | D.纯碱溶液 |
II、合成氨的流程示意图如下:
回答下列问题:
(1)工业合成氨的原料是氮气和氢气。氮气是从空气中分离出来的,通常使用的两种分离方法是 , ;氢气的来源是水和碳氢化合物,写出分别采用煤和天然气为原料制取氢气的化学反应方程式 , ;
(2)设备A中含有电加热器、触煤和热交换器,设备A的名称 ,其中发生的化学反应方程式为 ;
(3)设备B的名称 ,其中m和n是两个通水口,入水口是 (填“m”或“n”)。不宜从相反方向通水的原因 ;
(4)设备C的作用 ;
(5)在原料气制备过程中混有CO对催化剂有毒害作用,欲除去原料气中的CO,可通过如下反应来实现:CO(g)+H2O(g) CO2 (g)+ H2 (g),已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于 。
CO2 (g)+ H2 (g),已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于 。
(15分)目前,“低碳经济”备受关注,CO2的产生及有效开发利用成为科学家研究的重要课题。
(1)向浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙(粒子直径在1〜10nm之间)。
①向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入NH3,后通 入CO2。制备纳米级碳酸钙的离子方程式为______________
②判断产品中是否含有纳米级碳酸钙的实验方法为_____________。
(2)—定条件下,C(s)和H2O(g)反应,能生成CO2(g)和H2(g)。将C(s)和H2O(g)分别加入甲、乙两个密闭容器中,发生反应:C(s)+2H2O(g) CO2(g)+2H2(g),其相关数据如下表所示:
CO2(g)+2H2(g),其相关数据如下表所示:
①T10C时,该反应的平衡常数K=_______
②乙容器中,当反应进行到1.5min时,H20(g)的物质的量浓度_______ (填选项字母)。
A.=0.8 mol/L B.-1.4 mol/L
C.<1.4 mol/L D.>1.4 mol/L
③丙容器的容积为1L,t20C时,起始充入a mol C02和bmol H2(g),反应达到平衡时,测得CO2的转化率大于H2的转化率,则 的值需满足的条件为______________;
的值需满足的条件为______________;
④丁容器的容积为1L,T10C时,按下列配比充入C(s)、H2O(g)、CO2(g)和H2(g),达到平衡时各气体的体积分数与甲容器完全相同的是_______(填选项字母)。
A.0.6 mol、1.0 mol、0.5 mol、1.0 mol
B.0.6 mol、2.0 mol、O mol、O mol
C.1.0 mol、2.0 mol、1.0 mol、2.0 mol
D.0.25 mol、0.5 mol、0.75 mol、1.5 mol
(3)CO2在一定条件下可转化为甲醚(CH3OCH3)。用甲醚燃料电池做电源,用惰性电极电解饱和K2SO4溶液可制取H2SO4和KOH,实验装置如下图所示:
①甲醚燃料电池的负极反应式为________
②A口导出的物质为_____________________(填化学式)。
③若燃料电池通入CH3OCH3(g)的速率为0.1mol/min-1 ,2 min时,理论上C口收集到标准状况下气体的体积为______________
Ⅰ.铁及其化合物之间的相互转化可用下式表示: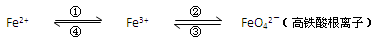
回答下列有关问题:
(1)Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液,实现上述①的转化,要求产物纯净。可选用的试剂是 (选填序号);
a.Cl2 b.Fe c.HNO3 d.H2O2
(2)上述转化得到的硫酸铁可用于电化浸出黄铜矿精矿工艺。精矿在阳极浸出的反应比较复杂,其中有一主要反应:CuFeS2+4Fe3+=Cu2++5Fe2++2S。
则下列说法正确的是 (选填序号);
a.从物质分类的角度看,黄铜矿属于合金
b.反应中,所有铁元素均被还原
c.反应中,CuFeS2既作氧化剂又作还原剂
d.当转移1mol电子时,有46 g CuFeS2参加反应
(3)下述反应中,若FeSO4和O2的系数比为2:1,试配平下列方程式: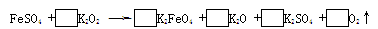
(4)高铁酸钾(K2FeO4)是一种新型、高效的绿色水处理剂,在水中发生反应生成氢氧化铁胶体。高铁酸钾作为水处理剂发挥的作用是_______、_________。
Ⅱ.在100℃时,将0.100 mol的四氧化二氮气体充入1 L恒容抽真空的密闭容器中,发生反应:N2O4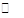 2NO2,隔一定时间对该容器内的物质浓度进行分析得到下表数据:
2NO2,隔一定时间对该容器内的物质浓度进行分析得到下表数据:
| 时间(s) |
0 |
20 |
40 |
60 |
80 |
| c(N2O4)/mol/L |
0.100 |
c1 |
0.050 |
c3 |
c4 |
| c(NO2)/mol/L |
0.000 |
0.060 |
c2 |
0.120 |
0.120 |
(1)该反应的平衡常数表达式为__________;从表中数据分析:c1___c2;(填“>”、“<”或“=”).
(2)在下图中画出并标明此反应中N2O4和NO2的浓度随时间变化的曲线.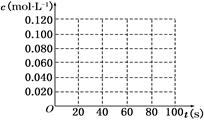
(3)在上述条件下,从反应开始至达到化学平衡时,N2O4的平均反应速率为________mol/(L·s).
(4)达平衡后下列条件的改变可使NO2气体浓度增大的是________.
A.增大容器的容积 B.再充入一定量的N2O4
C.分离出一定量的NO2 D.再充入一定量的He
(5)若起始时充入NO2气体0.080 mol,则达到平衡时NO2气体的转化率为________.
(10分)(1)将水蒸气通过红热的碳可产生水煤气:
C(s)+H2O(g) CO(g)+H2(g) △H=+131.3kJ/mol,
CO(g)+H2(g) △H=+131.3kJ/mol,
达到平衡后,体积不变时,能提高H2O的平衡转化率的措施是 。
| A.升高温度 | B.增加碳的用量 |
| C.加入催化剂 | D.用CO吸收剂除去CO |
(2)将一定量的CO(g)和H2O(g)通过某恒容的密闭容器中,发生反应:CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
得到如下数据:
| 温度/℃ |
起始浓度mol/L |
平衡浓度mol/L |
|
| CO(g) |
H2O(g) |
H2(g) |
|
| 900 |
2.0 |
0.8 |
0.4 |
求该反应的平衡常数数值 。
(3)工业上把水煤气中的混合气体处理后,获得较纯的H2用于合成氨:N2(g)+3H2(g) 2NH3(g) △H= —92.4kJ/mol某同学在不同实验条件下模拟化工生产进行实验,N2浓度随时间变化如图:
2NH3(g) △H= —92.4kJ/mol某同学在不同实验条件下模拟化工生产进行实验,N2浓度随时间变化如图:
①与实验I比较,实验II改变的条件为: 。
②实验III比实验I的温度要高,其它条件相同,请在下图画出实验I和实验III中NH3浓度随时间变化的示意图。
(4)下图中P是可自由平行滑动的活塞。在相同温度时,向A容器中充入4 mol SO3(g),关闭K,向B容器中充入2 mol SO3(g),两容器分别发生反应。
已知起始时容器A和B的体积均为aL。
试回答:
①反应达到平衡时容器B的体积为1.2a L,容器B中SO3转化率为 。
②若打开K,一段时间后重新达到平衡,容器B的体积为 __ L(连通管中气体体积忽略不计,且不考虑温度的影响)。
(10分)氨的合成是最重要的化工生产之一。
I.工业上合成氨用的H2有多种制取的方法:
① 用焦炭跟水反应:C(s)+ H2O(g) 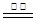 CO(g)+ H2(g);
CO(g)+ H2(g);
② 用天然气跟水蒸气反应:CH4(g)+ H2O(g) CO (g)+ 3H2(g)
CO (g)+ 3H2(g)
已知有关反应的能量变化如下图,则方法②中反应的ΔH=_____________。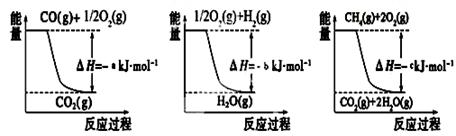
Ⅱ.在同温度下、使用相同催化剂分别进行反应:
3H2(g)+ N2(g)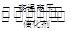 2NH3(g),按不同方式在2L容器中投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
2NH3(g),按不同方式在2L容器中投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
| 容 器 |
甲 |
乙 |
丙 |
| 反应物投入量 |
3 mol H2、2 mol N2 |
6 mol H2、4mol N2 |
2 mol NH3 |
| 达到平衡的时间(min) |
t |
5 |
8 |
| 平衡时N2的浓度(mol·L-1) |
c1 |
1.5 |
|
| N2的体积分数 |
ω1 |
ω2 |
ω3 |
| 混合气体密度(g·L-1) |
ρ1 |
ρ2 |
|
(1)下列能说明该反应已达到平衡状态的是
a.容器内N2、H2、NH3的浓度之比为1︰3︰2b.v(N2)正=3v(H2)逆c.容器内压强保持不变d.混合气体的密度保持不变
(2)甲容器中达到平衡所需要的时间t 5min (填>、<或=)
(3)乙中从反应开始到平衡时N2的平均反应速率 (注明单位)。
(4)分析上表数据,下列关系正确的是________。
a.2c1=1.5mol/L b.ω1=ω2 c.2ρ1=ρ2
(5)该温度下,容器乙中,该反应的平衡常数K=____ __(用分数表示)。
(13分)天然气的主要成分是甲烷,它是一种重要的燃料和基础化工原料。
(1)以甲烷和水为原料可制取甲醇。
①CH4(g)+H2O(g) CO(g)+3H2(g) △H=+206.0kJ/mol
CO(g)+3H2(g) △H=+206.0kJ/mol
②CO(g)+2H2(g) CH3OH(g) △H=—129.0kJ/mol
CH3OH(g) △H=—129.0kJ/mol
则CH4(g)+H2O(g) CH3OH(g)+H2(g)的△H=__________kJ/mol。
CH3OH(g)+H2(g)的△H=__________kJ/mol。
(2)用甲烷催化还原NOx为N2可消除氮氧化物的污染,写出反应的化学方程式_______。
(3)一定条件下,反应CH4(g)+H2O(g) CO(g)+3H2(g)可以制取合成氨的原料气H2。将1.0mol CH4和2.0 mol H2O(g)通入容积为100L的反应室,CH4的平衡转化率与温度的关系如图。已知100℃时达到平衡所需的时间是5min,则用H2表示的反应速率v(H2)=___________;该温度时的平衡常数K=__________,该反应的△H_______0(填“<”、“>”或“=”)。
CO(g)+3H2(g)可以制取合成氨的原料气H2。将1.0mol CH4和2.0 mol H2O(g)通入容积为100L的反应室,CH4的平衡转化率与温度的关系如图。已知100℃时达到平衡所需的时间是5min,则用H2表示的反应速率v(H2)=___________;该温度时的平衡常数K=__________,该反应的△H_______0(填“<”、“>”或“=”)。
(4)某化学小组设计如图装置进行饱和NaCl溶液电解实验。
请回答下列问题:
已知每个甲烷燃料电池中盛有1.0L2.0 mol/L的KOH溶液。标准状况下,当每个燃料电池的负极通入甲烷的体积均为33.6L,且反应完全,则理论上电池溶液中c(K2CO3)_______c(KHCO3)(填“<”、“>”或“=”):最多能产生标准状况氯气的体积为________L。
18.甲醇可通过将煤的气化过程中生成的CO和H2在一定条件下发生如下反应制得:CO(g) + 2H2(g)=CH3OH(g)
请根据下图回答下列问题:
(1)从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)=____mol / (L·min)。
(2)写出该反应的热化学方程式_____________________________________________________
(3)恒容条件下,下列措施中能使 n(CO) /n(CH3OH)增大的有 。
A.升高温度 B.充入He气
C.再充入1 mol CO和2 mol H2 D.使用催化剂
(4)若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如下表:
| 容器 |
反应物投入的量 |
反应物的转化率 |
CH3OH的浓度 |
能量变化(Q1、Q2、Q3均大于0) |
| 甲 |
1 mol CO和2 mol H2 |
a1 |
c1 |
放出Q1kJ热量 |
| 乙 |
1mol CH3OH |
a2 |
c2 |
吸收Q2kJ热量 |
| 丙 |
2mol CO和4 mol H2 |
a3 |
c3 |
放出Q3kJ热量 |
则下列关系正确的是:
A. c1=c2
B.2Q1=Q3
C.2a1=a3
D.a1+ a3=1
E.该反应若生成1 mol CH3OH,则放出(Q1+ Q2)kJ热量
(5)若在一体积可变的密闭容器中充入1molCO、2mol H2和1mol CH3OH,达到平衡时测得混合气体的密度是同温同压下起始的1.6倍,则该反应向 (填“正”、“逆”)反应方向移动,理由是由质量守恒,密度为原来的1.6倍,所以体积缩小,平衡正移。
工业上用NH3和CO2反应合成尿素:
2NH3(g)+ CO2(g) CO(NH2)2(g)+ H2O(g) △H1 =" -536.1" kJ·mol-1
CO(NH2)2(g)+ H2O(g) △H1 =" -536.1" kJ·mol-1
(1)此反应的平衡常数表达式K= 。升高温度,K值 (填增大、减小或不变)。
(2)其他条件不变,下列方法能同时提高化学反应速率和尿素产率的是 。
| A.通入氦气 | B.缩小体积 |
| C.加入催化剂 | D.除去体系中的水蒸气 |
(3)尿素可用于处理汽车尾气。CO(NH2)2(g)与尾气中NO反应生成CO2、N2、H2O(g)排出。又知:4NH3(g)+ 6NO(g)= 5N2(g)+ 6H2O(g) △H2 =" -1806.4" kJ·mol-1,写出CO(NH2)2(g)与NO反应的热化学方程式 。
某小组模拟工业合成尿素,探究起始反应物的氨碳比[n(NH3)/n(CO2)]对尿素合成的影响。在恒温下1L容器中,将总物质的量为3mol的NH3和CO2以不同的氨碳比进行反应,实验测得平衡体系中各组分的变化如图所示。回答问题: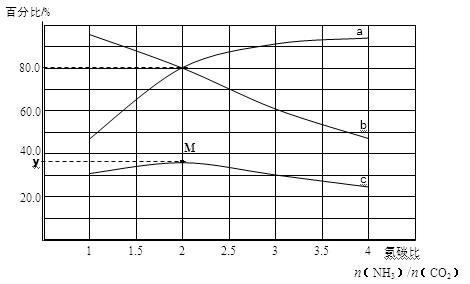
(4)若a、b线分别表示NH3或CO2转化率的变化,其中表示NH3转化率的是 (填a或b)线。
(5)若a、b线分别表示NH3或CO2转化率的变化,c线表示平衡体系中尿素体积分数的变化,求M点对应的y值(写出计算过程,结果精确到0.1)。
倡导“低碳经济”。降低大气中CO2的含量,有利于解决气候变暖的环境问题。
(1)工业上可用CO2来生产燃料甲醇。反应原理为:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H<0.
CH3OH(g)+H2O(g) △H<0.
一定温度下,在体积为2L的恒容密闭容器中,充入2molCO2和6molH2.一定条件下发生反应:测得CO2和CH3OH的浓度随时间变化如图所示。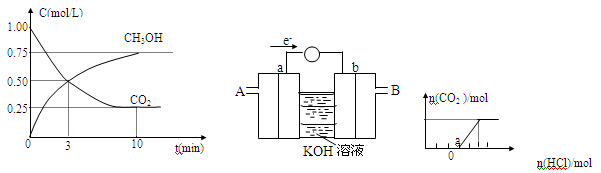
①达到平衡时,CO2的转化率= 。
②从反应开始到平衡。氢气的平均反应速率V(H2)= mol/(L·min)。
③容器内的平衡压强与起始压强之比为 。
④保持容器容积不变,下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是 。
| A.升高温度 | B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离出来 | D.再充入1molCO2和3molH2 |
⑤某同学依据甲醇燃烧的反应原理,设计如上图所示的电池装置,a、b均为惰性电极。使用时,空气从 口通入(填“A”或“B”):a极的电极反应式为 。
(2)将一定量的CO2气体通入NaOH溶液中,再向所得溶液中逐滴加入盐酸,边加边振荡至过量,产生的气体与HCl物质的量关系如上图所示(忽略气体的溶解和HCl的挥发)。请回答:O点溶液中溶质的化学式 ,a点溶液中各离子浓度由大到小的顺序是 。
液氨常用作制冷剂,回答下列问题
(1)一定条件下在密闭容器中发生反应:
a.NH4I(s)  NH3(g) + HI(g) b.2HI(g)
NH3(g) + HI(g) b.2HI(g)  H2(g) + I2(g)
H2(g) + I2(g)
① 写出反应a的平衡常数表达式
② 达到平衡后,扩大容器体积,反应b的移动方向 (填“正向”、“逆向”或“不移动”),达到新的平衡时容器内颜色将怎样变化 (填“加深”、“变浅”或“不变”)
(2)工业上合成氨的反应:N2(g)+3H2(g)  2NH3(g) ΔH=-92.60 kJ·mol-1
2NH3(g) ΔH=-92.60 kJ·mol-1
下列说法能说明上述反应向正反应方向进行的是________ (填序号)。
a.单位时间内生成2n mol NH3的同时生成3n mol H2
b.单位时间内生成6n mol N—H键的同时生成2n mol H—H键
c.用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1∶3∶2
d.混合气体的平均摩尔质量增大
e.容器内的气体密度不变
(3)已知合成氨反应在某温度下2 L的密闭容器中进行N2(g)+3H2(g)  2NH3(g) ΔH=-92.60 kJ·mol-1,测得如下数据:
2NH3(g) ΔH=-92.60 kJ·mol-1,测得如下数据:
 时间(h)物质的量(mol) 时间(h)物质的量(mol) |
0 |
1 |
2 |
3 |
4 |
| N2 |
1.50 |
n1 |
1.20 |
n3 |
1.00 |
| H2 |
4.50 |
4.20 |
3.60 |
n4 |
3.00 |
| NH3 |
0 |
0.20 |
n2 |
1.00 |
1.00 |
根据表中数据计算:
①反应进行到2 h时放出的热量为________ kJ。
②0~1 h内N2的平均反应速率为________ mol·L-1·h-1。
③此温度下该反应的化学平衡常数K=________(保留两位小数)。
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00 mol,化学平衡将向________方向移动(填“正反应”或“逆反应”)。
(4)肼(N2H4)的性质类似于NH3,极易溶于水,与水反应生成一种二元弱碱在溶液中分步电离,请用离子反应方程式表示其水溶液显碱性的原因 。
(1)利用H2S废气制取氢气的方法有多种。
①高温热分解法:已知: 在恒容密闭容器中,控制不同温度进行H2S分解实验。
在恒容密闭容器中,控制不同温度进行H2S分解实验。
以H2S起始浓度均为c mol/L测定H2S的转化率,结果见图。图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。 _____________0(填>,=或<):说明随温度的升高,曲线b向曲线a靠近的原因: _____________________。
_____________0(填>,=或<):说明随温度的升高,曲线b向曲线a靠近的原因: _____________________。
②电化学法
该法制氢过程的示意图如图。反应池中反应的离子方程式是___________________;
反应后的溶液进入电解池,电解总反应的离子方程式为________________。
(2)以Al和NiO(OH)为电极,NaOH溶液为电解液可以组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2。
①该电池的负极反应式_______________________________________________。
②电池总反应的化学方程式_________________________________________________。
(3)某亚硝酸钠固体中可能含有碳酸钠和氢氧化钠,现测定亚硝酸钠的含量。
已知:5NaNO2+2KMnO4+3H2SO4=5NaNO3+2MnSO4+K2SO4+3H2O
称取4.000g固体,溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol/L,酸性KmnO4溶液进行滴定,实验所得数据如下表所示;
| 滴定次数 |
1 |
2 |
3 |
4 |
| KMnO4溶液体积/mL |
20.60 |
20.02 |
20.00 |
19.98 |
①滴入最后一滴酸性KMnO4溶液,溶液__________________________,30秒内不恢复,可判断达到滴定终点。
②第一组实验数据出现异常,造成这种异常的原因可能是____________(填序号)。
A.酸式滴定管用蒸馏水洗净后未用标准液润洗
B.锥形瓶洗净后未干燥
C.滴定终了仰视读数
③根据表中数据,计算所得固体中亚硝酸钠的质量分数_____________。
液氨常用作制冷剂,回答下列问题
(1)一定条件下在密闭容器中发生反应:
a.NH4I(s)  NH3(g) + HI(g)
NH3(g) + HI(g)
b.2HI(g)  H2(g) + I2(g)
H2(g) + I2(g)
①写出反应a的平衡常数表达式
②达到平衡后,扩大容器体积,反应b的移动方向 (填“正向”、“逆向”或“不移动”),达到新的平衡时容器内颜色将怎样变化 (填“加深”、“变浅”或“不变”)
(2)工业上合成氨的反应:N2(g)+3H2(g)  2NH3(g) ΔH=-92.60 kJ·mol-1
2NH3(g) ΔH=-92.60 kJ·mol-1
下列说法能说明上述反应向正反应方向进行的是________(填序号)。
a.单位时间内生成2n mol NH3的同时生成3n mol H2
b.单位时间内生成6n mol N—H键的同时生成2n mol H—H键
c.用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1∶3∶2
d.混合气体的平均摩尔质量增大
e.容器内的气体密度不变
(3)已知合成氨反应在某温度下2 L的密闭容器中进行,测得如下数据:
根据表中数据计算:
①反应进行到2 h时放出的热量为________ kJ。
②0~1 h内N2的平均反应速率为________ mol·L-1·h-1。
③此温度下该反应的化学平衡常数K=________(保留两位小数)。
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00 mol,化学平衡将向________方向移动(填“正反应”或“逆反应”)。
(4)肼(N2H4)的性质类似于NH3,极易溶于水,与水反应生成一种二元弱碱在溶液中分步电离,请用离子反应方程式表示其水溶液显碱性的原因 。
二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放。
(1)在一定温度下的2L固定容积的密闭容器中,通入2 molCO2和3mol H2,发生的反应为:CO2(g)+3H2(g) ⇌CH3OH(g)+H2O(g),△H=-a kJ·mol-1(a>0), 测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
①能说明该反应已达平衡状态的是________。(选填编号)
A.CO2的体积分数在混合气体中保持不变
B.混合气体的平均相对分子质量不随时间的变化而变化
C.单位时间内每消耗1.2mol H2,同时生成0.4molH2O
D.该体系中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变
②计算该温度下此反应的平衡常数K=_________。(保留两位有效数字)。若改变条件 (填选项),可使K=1。
A.增大压强
B.增大反应物浓度
C.降低温度
D.升高温度
E.加入催化剂
(2)某甲醇燃料电池原理如图1所示。
①M区发生反应的电极反应式为_______________________________。
②用上述电池做电源,用图2装置电解饱和食盐水(电极均为惰性电极),则该电解的总反应离子方程式为: 。假设溶液体积为300mL,当溶液的pH值变为13时(在常温下测定),理论上消耗甲醇的质量为______________(忽略溶液体积变化)。
(3)有一种用CO2生产甲醇燃料的方法:
已知:①CO2(g)+3H2(g)  CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
②CH3OH(g)=CH3OH(l) △H=-b kJ·mol-1;
③2H2(g)+O2(g)=2H2O(g) △H=-c kJ·mol-1;
④H2O(g)=H2O(l) △H=-d kJ·mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:_____________________________
(12分)数十年来,化学工作者对碳的氧化物做了广泛深入的研究并取得了一些重要成果。
已知:C(s)+O2(g)=CO2(g);ΔH=-393 kJ·mol-1
2CO (g)+O2(g)=2CO2(g);ΔH=-566 kJ·mol-1
2H2(g)+O2(g)=2H2O(g);ΔH=-484 kJ·mol-1
(1)工业上常采用将水蒸气喷到灼热的炭层上实现煤的气化(制得CO、H2),该反应的热化学方程式是 。
(2)上述煤气化过程中需向炭层交替喷入空气和水蒸气,喷入空气的目的是 。
(3)CO常用于工业冶炼金属,下图是在不同温度下CO还原四种金属氧化物达平衡后气体中lg[c(CO)/c(CO2)]与温度(t)的关系曲线图。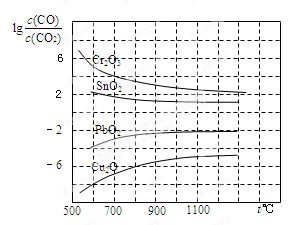
下列说法正确的是 。
A.工业上可以通过增高反应装置来延长矿石和CO接触的时间,减少尾气中CO的含量
B.CO不适宜用于工业冶炼金属铬(Cr)
C.工业冶炼金属铜(Cu)时较低的温度有利于提高CO的利用率
D.CO还原PbO2的反应ΔH>0
(4)某二元弱酸(简写为H2A)溶液,按下式发生一级和二级电离:H2A H++HA-,HA-
H++HA-,HA- H++A2-。已知相同浓度时的电离程度H2A>HA-,设有下列四种溶液:
H++A2-。已知相同浓度时的电离程度H2A>HA-,设有下列四种溶液:
A.0.01mol/L的H2A溶液;
B.0.01mol/L的NaHA溶液;
C.0.02mol/L的HCl与0.04mol/L的NaHA溶液等体积混合液;
D.0.02mol/L的NaOH与0.02 mol/L的NaHA溶液等体积混合液。
据此,填写下列空白(填代号)
(1)c(H+)最大的是 ,最小的是 ;
(2)c(H2A)最大的是 ,最小的是 ;
(3)c(A2-)最大的是 ,最小的是 。
试题篮
()