下列说法正确的是
| A.饱和氯水中加水稀释,促进氯水中水的电离 |
| B.向氨水中加入氯化铵,由于氯化铵溶液呈酸性,所以溶液pH降低 |
C.碳酸钠溶液中存在CO32-+H2O  HCO3-+OH-平衡,若通入CO2,则平衡逆向移动 HCO3-+OH-平衡,若通入CO2,则平衡逆向移动 |
| D.向氢氧化镁悬浊液中加水稀释,Mg(OH)2沉淀溶解平衡正向移动,但c(Mg2+)降低 |
某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g) 2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据图示可得出的判断结论正确的是
2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据图示可得出的判断结论正确的是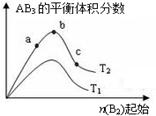
| A.达到平衡时,AB3的物质的量大小为:c>b>a |
| B.达到平衡时,A2的转化率大小为:b>a>c |
| C.若T2>T1,则正反应一定是放热反应 |
| D.a点的化学平衡常数小于c点的化学平衡常数 |
将0.l mol·L-1醋酸溶液加水稀释,下列说法正确的是
| A.溶液中c(H+)和c(OH-)都减小 | B.溶液中c(H+)增大 |
| C.醋酸电离平衡向左移动 | D.溶液的pH增大 |
在体积相同的A、B两个带活塞的玻璃容器中,分别注入1/4体积颜色相同的NO2与溴蒸气,然后将活塞同时向外拉出到1/2(快速),过一会可以看到
A、A中的颜色比B中的浅 B、A中的颜色比B中的深
C、A中的颜色与B中的深浅相同 D、A中颜色比开始时深
可以充分说明反应 在恒温下已达到平衡的是
在恒温下已达到平衡的是
| A.反应容器内的压强不随时间改变 |
| B.反应容器内P、Q、R、S四者共存 |
| C.P的生成速率和S的生成速率相等 |
| D.反应容器内的气体总物质的量不随时间变化 |
在容积一定的密闭容器中发生可逆反应 ,
, ;平衡移动关系如图所示。下列说法正确的是
;平衡移动关系如图所示。下列说法正确的是
| A.P1< P2,纵坐标指A的质量分数 |
| B.P1> P2,纵坐标指C的质量分数 |
| C.P1< P2,纵坐标指A的转化率 |
| D.P1< P2,纵坐标指混合气体的平均摩尔质量 |
下列事实,不能用勒夏特列原理解释的是( )
| A.硫酸工业中,增大O2的浓度有利于提高SO2的转化率 |
B.对2HI H2+I2平衡体系增加压强使颜色变深 H2+I2平衡体系增加压强使颜色变深 |
| C.开启啤酒瓶后,瓶中立刻泛起大量泡沫 |
| D.滴有酚酞的氨水溶液,适当加热溶液(氨气不挥发)后颜色变深 |
在一定温度下的定容密闭容器中,当物质的下列物理量不再变化时,不能说明反应
A(s)+2B(g) C(g)+D(g)已达平衡状态的是( )
C(g)+D(g)已达平衡状态的是( )
| A.混合气体的压强 | B.混合气体的密度 |
| C.B的物质的量浓度 | D.气体的平均相对分子质量 |
对于可逆反应:A2(g)+3B2(g)  2AB3(g) △H<0,下列图像正确的是( )
2AB3(g) △H<0,下列图像正确的是( )
(友情提示:V-速率; W(AB3)-AB3的质量分数)
下列说法错误的是( )
| A.由单质A转化为单质B,ΔH=+119kJ/mol,可知单质A比单质B稳定 |
| B.灼热的碳与CO2反应既是氧化还原反应,又是生成物总能量高于反应物总能量的反应 |
| C.决定化学反应速率的根本因素是参加反应的各物质的结构和性质 |
| D.对于一个可逆反应(ΔH<0)达到平衡后,升高温度可以增加活化分子的百分数,提高有效碰撞的次数,使V正增大的倍数大于V逆增大的倍数,从而使化学反应平衡逆向移动 |
某温度下,在一个2L的密闭容器中,加入4molA和2molB进行如下反应: 3A(s)+2B(g) 4C(g)+D(g),反应2min后达到平衡,测得生成l.6molC,下列说法正确的是
4C(g)+D(g),反应2min后达到平衡,测得生成l.6molC,下列说法正确的是
| A.前2min,D的平均反应速率为0.2mol·L-1·min-1。 |
| B.此时,B的平衡转化率是40% |
| C.增大该体系的压强,平衡不移动,化学平衡常数不变 |
| D.增加B,平衡向右移动,B的平衡转化率增大 |
室温下,水的电离达到平衡:H2O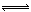 H++OH‾。下列叙述正确的是
H++OH‾。下列叙述正确的是
| A.将水加热,平衡向正反应方向移动,KW不变 |
| B.向水中加入少量盐酸,平衡向逆反应方向移动,c(H+)增大 |
| C.向水中加入少量NaOH固体,平衡向逆反应方向移动,c(OH—)降低 |
| D.向水中加入少量CH3COONa固体,平衡向正反应方向移动,c(0H—)=c(H+) |
在一定条件下,固定容积的密闭容器中反应:2NO2(g)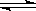 O2(g)+2NO(g) △H>0,达到平衡。当改变其中一个条件x,y随x变化符合图中曲线的是
O2(g)+2NO(g) △H>0,达到平衡。当改变其中一个条件x,y随x变化符合图中曲线的是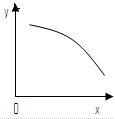
| A.当x表示温度时,y表示NO物质的量 |
| B.当x表示反应时间时,y表示混合气体的密度 |
| C.当x表示压强时,y表示NO2的转化率 |
| D.当x表示NO2物质的量时,y表示O2的物质的量 |
下列事实可以用勒夏特列原理解释的是( )
| A.新制的氯水在光照条件下颜色变浅 |
| B.使用催化剂,提高合成氨的产率 |
| C.高锰酸钾(KMnO4)溶液加水稀释后颜色变浅 |
| D.H2、I2、HI平衡混合气体加压后颜色变深 |
试题篮
()