在一定温度条件下,对于已达到平衡的反应:
FeCl3 +3KSCN  3KCl+Fe(SCN)3,在此溶液中作如下处理,平衡左移的是
3KCl+Fe(SCN)3,在此溶液中作如下处理,平衡左移的是
| A.加入少量氯化钾固体 | B.加入少量氯化铁固体 |
| C.减少Fe(SCN)3的浓度 | D.加水稀释 |
可逆反应N2+3H2 2NH3的正逆反应速率可用各反应物或生成物浓度的变化来表示下列各关系中能说明反应已达到平衡状态
2NH3的正逆反应速率可用各反应物或生成物浓度的变化来表示下列各关系中能说明反应已达到平衡状态
| A.3v正(N2)=v正(H2) | B.v正(H2)=v逆(NH3) |
| C.2v正(H2)=3v逆(NH3) | D.v正(N2)=3v逆(H2) |
已知H2(g)+I2(g) 2HI(g)△H<0,有相同容积的定容密封容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入HI0.2mol,相同温度下分别达到平衡,欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是
2HI(g)△H<0,有相同容积的定容密封容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入HI0.2mol,相同温度下分别达到平衡,欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是
| A.甲、乙提高相同温度 | B.甲中加入0.1molHe,乙不改变 |
| C.甲降低温度,乙不变 | D.甲增加0.1mol H2,乙增加0.1mol I2 |
可逆反应mA(g)+nB pC(g)+qD中,A和C都是无色气体,达到平衡后,下列叙述正确的是 ( )。
pC(g)+qD中,A和C都是无色气体,达到平衡后,下列叙述正确的是 ( )。
A.若增加B的量,平衡体系颜色加深,说明B必是气体
B.增大压强,平衡不移动,说明m+n一定等于p+q
C.升高温度,A的转化率减小,说明正反应是吸热反应
D.若B是气体,增大A的量,A、B的转化率都增大
向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g)⇌SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如右所示.由图可得出的正确结论是
| A.反应在c点达到平衡状态 |
| B.反应物浓度:a点小于b点 |
| C.反应物的总能量低于生成物的总能量 |
| D.△t1=△t2时,SO2的转化率:a~b段小于b~c段 |
在一个不传热的固定容积的密闭容器中发生可逆反应:mA(g) + nB(g) ⇌pC(g) + qD(g) ,当m、n、p、q为任意整数(不为零)时,不能说明达到平衡状态的标志是
| A.D的质量不再改变 |
| B.各组分的浓度不再改变 |
| C.反应速率υA:υB:υC:υD=m:n:p:q |
| D.单位时间内m mol A断键发生反应,同时p mol C也断键发生反应 |
已知H2(g)+I2(g)  2HI(g) ΔH<0。有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1 mol,乙中加入HI 0.2 mol,在相同温度下分别达到平衡。现欲使甲中HI平衡时的百分含量大于乙中HI平衡时的百分含量,则应采取的措施是( )
2HI(g) ΔH<0。有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1 mol,乙中加入HI 0.2 mol,在相同温度下分别达到平衡。现欲使甲中HI平衡时的百分含量大于乙中HI平衡时的百分含量,则应采取的措施是( )
| A.甲中充入HI气体,乙中不变 | B.甲降低温度,乙增大压强 |
| C.甲中加入0.1 mol He,乙中不变 | D.甲增加0.1 mol H2,乙增加0.1 mol I2 |
在容积不变的密闭容器中,一定条件下发生反应:2A ⇌B(g)+2C(g),且达到平衡。当升高温度时气体的密度增大,则下列叙述中正确的是
| A.升高温度,正反应速率增大,逆反应速率减小 |
| B.若正反应是放热反应,则A为气态 |
| C.若向容器中充入惰性气体,则平衡向右移动 |
| D.物质A一定为非气态,且正反应是吸热反应 |
在2000K时,反应CO(g)+1/2O2(g)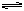 CO2(g)的平衡常数为K1,则相同温度下反
CO2(g)的平衡常数为K1,则相同温度下反
应2CO2(g)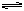 2CO(g)+O2(g)的平衡常数K2为( )
2CO(g)+O2(g)的平衡常数K2为( )
| A.1/K12 | B.K12 | C.1/K1 | D.K1-1/2 |
已知反应:2NO2(g)+4CO(g) N2(g)+4CO2(g) ΔH<0。将一定量的NO2与CO充入装有催化剂的注射器中后封口。右图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法不正确的是
N2(g)+4CO2(g) ΔH<0。将一定量的NO2与CO充入装有催化剂的注射器中后封口。右图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法不正确的是
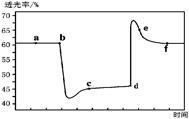
| A.b点的操作是快速压缩注射器 |
| B.c点与a点相比,c(NO2)、c(N2)都增大 |
C.e点: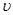 (正) < (正) <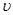 (逆) (逆) |
| D.若考虑体系温度变化,且没有能量损失,则平衡常数K(c) >K(f) |
一定温度下,反应2SO2+O2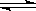 2SO3,达到平衡时,n (SO2):n(O2):n(SO3)=2:3:4。缩小体积,反应再次达到平衡时,n(O2)="0.8" mol,n(SO3)="1.4" mol,此时SO2的物质的量应是
2SO3,达到平衡时,n (SO2):n(O2):n(SO3)=2:3:4。缩小体积,反应再次达到平衡时,n(O2)="0.8" mol,n(SO3)="1.4" mol,此时SO2的物质的量应是
| A.1.2 mol | B.0.8 mol | C.0.6 mol | D.0.4 mol |
下列变化不能用勒夏特列原理解释的是
| A.红棕色的NO2气体加压后颜色先变深再变浅 |
| B.H2、I2、HI混合气体加压后颜色变深 |
| C.二氧化硫转化为三氧化硫时增加空气的量以提高二氧化硫的转化率 |
| D.打开汽水瓶,看到有大量的气泡逸出 |
某温度时,在一个容积为2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示,根据图中数据,下列有关说法错误的是( )
| A.该反应的化学方程式为3X+Y===2ZA |
| B.2 min时,反应达最大限度,但化学反应仍在进行 |
| C.反应开始至2 min,Z的反应速率为0.10 mol·L-1·min-1 |
| D.反应达到平衡时,压强是开始时的0.9倍 |
试题篮
()