对于可逆反应2SO2(g)+O2(g) 2SO3(g) ΔH<0,下列叙述正确的是
2SO3(g) ΔH<0,下列叙述正确的是
| A.单位时间内生成2molSO3的同时消耗了1molO2,则反应到达平衡状态 |
| B.升高温度反应速率增大,由于该反应是放热反应,V(逆)小于V(正),所以反应达到平衡的时间将延长 |
| C.保持温度和密闭体系体积不变,起始加入2molSO2和1molO2,平衡后加入2molSO2和1molO2,重到达平衡时SO2的体积分数减小 |
D.该反应的化学平衡常数表达式为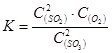 |
在一定温度下的某容积可变的密闭容器中,建立下列化学平衡:C(s)+H2O(g) CO(g)+H2(g),不能确定上述可逆反应在一定条件下已达到化学平衡状态的是
CO(g)+H2(g),不能确定上述可逆反应在一定条件下已达到化学平衡状态的是
| A.体系的压强不再发生变化 |
| B.v正(CO)=v逆(H2O) |
| C.生成nmolCO的同时生成nmolH2 |
| D.1molH—H键断裂的同时断裂2molH—O键 |
只改变一个影响因素,平衡常数K与化学平衡移动的关系叙述正确的是:
| A.K值不变,平衡不可能移动 |
| B.平衡向右移动时,K值一定增大 |
| C.K值有变化,平衡一定移动 |
| D.相同条件下,同一个反应,其方程式的计量数增大2倍,K值也增大两倍 |
一定条件下,体积为10L的密闭容器中,1molX和1molY进行反应:2X(g)+Y(g) Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是( )
Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是( )
| A.以X浓度变化表示的反应速率为0.001mol/(L·s) |
| B.将容器体积变为20L,Z的平衡浓度变为原来的1/2 |
| C.若增大压强,则物质Y的转化率减小 |
| D.若升高温度,X的体积分数增大,则该反应的△H>0 |
反应mX(g)  nY(g)+pZ(g) △H,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示。下列说法错误的是
nY(g)+pZ(g) △H,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示。下列说法错误的是

A.该反应的△H >0
B.m<n+p
C.B、C两点化学平衡常数:KB>KC
D.A、C两点的反应速率v(A)<v(C)
2 mol的PCl3和1 mol的Cl2混合后充入容积不变的密闭容器中,在一定条件下发生反应: PCl3(g)+Cl2(g) PCl5(g),达到平衡时,PCl5为0.4 mol。如果此时移走1 mol PCl3 和0.5 mol Cl2,在相同温度下再次达到平衡时,PCl5的物质的量( )
PCl5(g),达到平衡时,PCl5为0.4 mol。如果此时移走1 mol PCl3 和0.5 mol Cl2,在相同温度下再次达到平衡时,PCl5的物质的量( )
| A.等于0.4 mol | B.等于0.2 mol | C.小于0.2 mol | D.大于0.2 mol |
一定温度下,两个恒容密闭容器中分别发生反应:] ①H2(g)+I2(g) 2HI(g);②C(s)+H2O(g)
2HI(g);②C(s)+H2O(g) CO(g)+H2(g),下列状态能表明两反应都达到平衡状态的是
CO(g)+H2(g),下列状态能表明两反应都达到平衡状态的是
a.各物质的浓度不变;
b.容器内气体压强不变;
c.容器内气体密度不变;
d.容器内气体颜色不变;
e.各组分的物质的量分数或质量分数不变;
f.混合气体的平均分子量不变;
| A.ae | B.aef | C.abc | D.ac |
可逆反应aA(s)+bB(g) cC(g)+dD(g)进行过程中,当其他条件不变时,C的体积分数C%与温度(T)、压强(p)的关系如下图所示。下列叙述正确的是
cC(g)+dD(g)进行过程中,当其他条件不变时,C的体积分数C%与温度(T)、压强(p)的关系如下图所示。下列叙述正确的是
| A.达到平衡后,加入催化剂,C的体积分数增大 |
| B.达到平衡后,升高温度,平衡向左移动 |
| C.化学方程式中,b>c+d[ |
| D.达到平衡后,增加A的量,平衡向右移动 |
右图为某化学反应的速率与时间的关系示意图,在t1 时刻改变温度或压强,正逆反应速率的变化都符合示意图的反应是

A.2SO2(g)+O2(g) 2SO3(g);ΔH<0 2SO3(g);ΔH<0 |
B.4NH3(g)+5O2(g) 4NO(g)+6H2O(g);ΔH<0 4NO(g)+6H2O(g);ΔH<0 |
C.H2(g)+I2(g) 2HI(g); ΔH>0 2HI(g); ΔH>0 |
D.C(s)+H2O(g) CO(g)+H2(g);ΔH>0 CO(g)+H2(g);ΔH>0 |
在密闭容器中发生反应:aX(g)+bY(g) cZ(g)+dW(g) 反应达到平衡后,将容器体积压缩到原来的一半,当再次达到平衡时,W的浓度为原平衡状态的1.8倍。下列叙述不正确的是
cZ(g)+dW(g) 反应达到平衡后,将容器体积压缩到原来的一半,当再次达到平衡时,W的浓度为原平衡状态的1.8倍。下列叙述不正确的是
| A.平衡向逆反应方向移动 |
| B.(a+b) >(c+d) |
| C.Z的物质的量变小 |
| D.X的转化率变小 |
一定条件下,向密闭容器中加入 X物质,发生反应3X(g) Y(g)+Z(g) ΔH<0,反应一定时间后改变某一个外界条件,反应中各时刻X物质的浓度如下表所示,下列说法中不正确的是
Y(g)+Z(g) ΔH<0,反应一定时间后改变某一个外界条件,反应中各时刻X物质的浓度如下表所示,下列说法中不正确的是
| A.0~5min时,该反应的速率为v(X)="0.12" mol/(L·min) |
| B.5min时反应达到第一次平衡,该温度下的平衡常数数值为0.625 |
| C.15min时改变的条件不可能是升高温度 |
| D.从初始到18min时,X的转化率为30% |
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是:
A.反应的化学方程式为:2M N N |
| B.t2时,正逆反应速率相等,达到平衡 |
| C.t3时,正反应速率大于逆反应速率 |
| D.t1时,N的浓度是M浓度的2倍 |
在体积一定的密闭容器中给定物质A、B、C的量,在一定条件下发生反应建立的化学平衡:aA(g) + bB(g) xC(g),符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指( )
xC(g),符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指( )

A.反应物A的百分含量
B.平衡混合气中物质B的百分含量
C.平衡混合气的密度
D.平衡混合气的平均摩尔质量
在恒温、恒压条件下,反应N2 (g)+3H2 (g) 2NH3 (g)从两条途径分别建立平衡:
2NH3 (g)从两条途径分别建立平衡:
Ⅰ.N2、H2的起始浓度分别为1 mol / L和3 mol / L;
Ⅱ.NH3的起始浓度为4 mol / L。下列有关叙述不正确的是
| A.途径Ⅰ与途径Ⅱ所得混合气体的百分含量相同 |
| B.途径Ⅰ的反应速率v (N2)与途径Ⅱ的反应速率v (NH3)的比值为1∶2 |
| C.途径Ⅰ所得NH3的浓度与途径Ⅱ所得NH3的浓度之比为1∶2 |
| D.途径Ⅰ与途径Ⅱ所得平衡混合气体的物质的量之比为1∶2 |
试题篮
()