将等物质的量的F2和ClF混合,在密闭容器中发生反应: F2(g)+ClF(g)  ClF3(g);△H<0。下列叙述中,正确的是
ClF3(g);△H<0。下列叙述中,正确的是
| A.恒温恒容时,当ClF 转化40% 时,容器内的压强为初始时的0.6 倍 |
| B.若 c(F2):c (ClF): c (ClF3) ="1:" 1: 1,则反应一定达到平衡状态 |
| C.达到平衡后,若增大容器容积,则正反应速率减小,逆反应速率增大,平衡左移 |
| D.平衡后再降低温度,保持恒容,达到新的平衡,则混合气体的平均摩尔质量增大 |
在一定温度下,容器内某一反应中M、N的物质的量n随反应时间t变化的曲线如图所示,下列表述中正确的是
A.反应的化学方程式为2M N N |
| B.t2时V正=V逆,达到平衡 |
| C.t3时V正> V逆 |
| D.t1时浓度c(N)=2c(M) |
超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO 2CO2+N2。若利用飞机释放的NO和CO作为反应原料,在温度一定体积为10L的容器中反应,下列说法正确的是
2CO2+N2。若利用飞机释放的NO和CO作为反应原料,在温度一定体积为10L的容器中反应,下列说法正确的是
| A.若达平衡后充入稀有气体,体系压强增大,平衡将正向移动 |
| B.若升高温度可减少平衡体系中NO的浓度,则该反应△H > 0 |
| C.当体系中CO2和CO的浓度相等时,该反应达到平衡状态 |
| D.可以探索开发更加合适的催化剂,以提高尾气的转化率 |
现有带活塞的密闭容器A和B,一定温度时容器A装入碘化氢气体、容器B装入二氧化氮气体,使其体积相等。当温度不变时,缓缓压缩两容器,使两容器的压强均为原来的4倍,此时两容器内气体的体积关系正确的是(所有物质始终为气态)
| A.A="B" | B.A<B | C.无法判断 | D.A>B |
已知N2(g) +3H2(g)  2NH3(g) △H=-92.4kJ/mol。在一恒温恒压的密闭容器里充入2 mol N2和8 mol H2达到平衡时生成1 mol NH3。现在相同条件下的同一容器中充入xmol N2,ymol H2和2molNH3,达到平衡时,NH3的质量分数与原来相同,且放出热量46.2 kJ。则x、y的值为( )
2NH3(g) △H=-92.4kJ/mol。在一恒温恒压的密闭容器里充入2 mol N2和8 mol H2达到平衡时生成1 mol NH3。现在相同条件下的同一容器中充入xmol N2,ymol H2和2molNH3,达到平衡时,NH3的质量分数与原来相同,且放出热量46.2 kJ。则x、y的值为( )
| A.1.5,6.5 | B.2,8 | C.5,21 | D.3,13 |
在一定条件下,对于反应mA(g)+nB(g)  cC(g)+dD(g),C物质的浓度(c%)与温度、压强的关系如图所示,下列判断正确的是 ( )
cC(g)+dD(g),C物质的浓度(c%)与温度、压强的关系如图所示,下列判断正确的是 ( )
| A.△H<0 △S>0 |
| B.△H>0 △S<0 |
| C.△H>0 △S>0 |
| D.△H<0 △S<0 |
可逆反应A(g)+3B(g)  2C(g);ΔH<0。有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1mol A和3mol B,在一定条件下达到平衡时放出热量为Q1 kJ;在相同的条件下,向乙容器中加入2mol C达到平衡后吸收热量为Q2 kJ,已知Q1=3Q2。下列叙述不正确的是
2C(g);ΔH<0。有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1mol A和3mol B,在一定条件下达到平衡时放出热量为Q1 kJ;在相同的条件下,向乙容器中加入2mol C达到平衡后吸收热量为Q2 kJ,已知Q1=3Q2。下列叙述不正确的是
A.平衡时甲中A的转化率为75%
B.平衡时甲中A的转化率和乙中C的转化率相同
C.达到平衡后,再向乙中加入0.25mol A、0.75mol B、1.5mol C,平衡向生成C的方向移动
D.乙中的热化学反应方程式为2C(g)  A(g)+3B(g);ΔH=+4Q2kJ/mol
A(g)+3B(g);ΔH=+4Q2kJ/mol
在恒压密闭容器M(如图Ⅰ)和恒容密闭容器N(如图Ⅱ)中,分别加入amol X和amol Y,起始时两容器体积均为V L,发生如下反应并达到化学平衡状态:2X(?)+Y(?)  xZ(g) ΔH<0。平衡时M中X、Y、Z的物质的量之比为1∶3∶4。下列判断正确的是
xZ(g) ΔH<0。平衡时M中X、Y、Z的物质的量之比为1∶3∶4。下列判断正确的是
| A.x=4 |
| B.若N中气体的密度如图Ⅲ所示,则X、Y都是气态 |
| C.若X为气体,Y为非气体,则平衡时M、N中Z的物质的量相等 |
| D.若X、Y均为气体,平衡时M中X的转化率小于N中X的转化率 |
在一固定容积的密闭容器中充入3mol A和1mol B,发生反应:3A(g)+B(g) xC(g),达到平衡后,C的体积分数为W%。若维持容器体积和温度不变,按0.9mol A、0.3mol B和2.1mol C为起始物质,达到平衡后,C的体积分数仍为W%,则x值可能为
xC(g),达到平衡后,C的体积分数为W%。若维持容器体积和温度不变,按0.9mol A、0.3mol B和2.1mol C为起始物质,达到平衡后,C的体积分数仍为W%,则x值可能为
A.1 B.2 C.3 D.任意值
在密闭容器中进行以下可逆反应:A(g)+B(g) C(g)+2D(?),在不同的条件下C的百分含量的变化情况如右图,则该反应描述正确的是
C(g)+2D(?),在不同的条件下C的百分含量的变化情况如右图,则该反应描述正确的是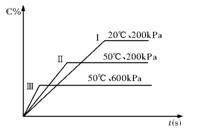
| A.正反应放热,D是固体 |
| B.正反应放热,D是气体 |
| C.正反应吸热,D是气体 |
| D.正反应放热,D是固体或气体 |
如图是关于N2+3H2 2NH3 ΔH<0的速率—时间图象,则t1时刻使平衡发生移动的原因是
2NH3 ΔH<0的速率—时间图象,则t1时刻使平衡发生移动的原因是
| A.升高温度,同时增大压强 |
| B.降低温度,同时减小压强 |
| C.增大反应物的浓度,同时使用适宜的催化剂 |
| D.增大反应物的浓度,同时减小生成物的浓度 |
在一定温度下,反应A2(g)+B2(g) 2AB(g)达到平衡的标志是
2AB(g)达到平衡的标志是
A.单位时间内生成nmol A2同时生成nmol的AB
B.容器内总压强不随时间而变化
C.v正(A)=2v逆(AB)
D.单位时间生成2mol AB同时生成了1mol A2
密闭容器中进行如下反应: X2(气) + Y2(气)  2Z(气), 已知 X2、Y2、Z的起始浓度分别为 0.1 mol/L, 0.3 mol/L, 0.2 mol/L, 在一定的条件下, 当反应达到平衡时, 各物质的浓度有可能是
2Z(气), 已知 X2、Y2、Z的起始浓度分别为 0.1 mol/L, 0.3 mol/L, 0.2 mol/L, 在一定的条件下, 当反应达到平衡时, 各物质的浓度有可能是 
| A.Y2为 0.35 mol/L | B.Y2为 0.2 mol/L |
| C.X2为 0.2 mol/L | D.Z 为 0.4 mol/L |
在一定温度下,可逆反应2SO2+O2 2SO3达到平衡状态的标志是
2SO3达到平衡状态的标志是
| A.容器中SO2、O2、SO3的分子数之比为2﹕1﹕2 |
| B.单位时间内生成nmol SO3,同时消耗n/2mol O2 |
| C.容器内的压强不随时间而变化 |
| D.生成SO3和生成O2的速率相同 |
试题篮
()