(1)在某压强恒定的密闭容器中加入2 molN2和4 molH2发生如下反应:
N2(g)+3H2(g) 2NH3(g);ΔH=-92.4 kJ/mol,当反应建立平衡时,此时容器体积为反应前的三分之二。则:
2NH3(g);ΔH=-92.4 kJ/mol,当反应建立平衡时,此时容器体积为反应前的三分之二。则:
①达到平衡时,N2的转化率为___________。
②若向该容器中加入a mol N2、b mol H2、c mol NH3,在相同条件下达到平衡时,混合物中各组分的百分含量与上述平衡相同,则a 、b、c应满足的关系为 。
(2)若将2 molN2和4 molH2放入起始体积相同的恒容容器中,在与(1)相同的温度下达到平衡,则平衡时NH3的浓度 (1) (2) (填“>”、“<”或“=”)。
(3)常温下,用0.10 mol/L NaOH溶液分别滴定20.00 mL 0.10mol/L HCl溶液和20.00 mL 0.10 mol/L CH3COOH溶液,得到2条滴定曲线,如下图所示:
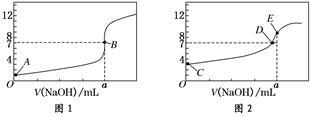
①NaOH溶液滴定HCl溶液的曲线是 (填“图1”或“图2”);
②图中c(Na+)=c(CH3COO-)的点是 (填A、B、C、D或E);
③滴定结束,经数据处理后发现a大于20.00ml,请你分析该同学测定a值偏大的原因可能是 。
合成尿素的反应为: 完成下列填空:
完成下列填空:
(1)写出NH3的电子式 ;画出碳原子结构示意图 ;氧元素位于周期表第 周期第 族。
(2)上述反应所涉及的4种元素,原子半径从大到小的排列顺序为 。
(3)上述反应所涉及的4种元素中,非金属性最强的是 。
(4)一定条件下,在10L的恒容密闭容器中,充入2mol NH3和1mol CO2,反应经5min后达到平衡,测得容器中水蒸气0.6mol,则平均反应速率v(NH3)= mol/(L·min)。
(5)下列能说明上述反应己达平衡的是 。(填序号)
a.2c(NH3)=c(H2O) b.CO2的浓度不变
c.v正(NH3):v正(CO2)=2:1 d.气体的压强不变
(6)为提高氨气的转化率,工业上用该反应生产尿素时,合适的反应条件是 。(填序号)
a.200℃ b.800℃ c.101kPa d.24000kPa
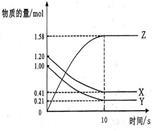
在某温度时,在2L容器中X、Y、Z三种气体物质的量随时间的变化关系曲线如图所示。
(1)由图中的数据分析,该反应的化学方程式为_____________。在该温度下,此化学反应的平衡常数表达式为_______________。
(2)反应开始至5min,Y的转化率为____________。
(3)在其他条件不变的情况下,如果起始充入X、Y、Z的物质的量分别为4mol、6mol、2mol,则此反应向___________(填“正反应”,“逆反应”)方向进行。
在一定温度下,将2 molA和2 molB两种气体相混合后于容积为2L的某密闭容器中,发生如下反应3A(g)+B(g) xC(g)+2D(g),2 min末反应达到化学平衡,生成了0.8 molD,并测得C的浓度为0.4 mol/L,请填写下列空白:
xC(g)+2D(g),2 min末反应达到化学平衡,生成了0.8 molD,并测得C的浓度为0.4 mol/L,请填写下列空白:
(1)x值等于_____________;
(2)A的转化率为 ;
(3)生成D的反应速率为 ;
(4)如果增大反应体系的压强,则平衡体系中C的质量分数将会 (填“增大”、“减小”或“不变”
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)⇌CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
| T/℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应为 反应(填“吸热”、“放热”)。
(2)能使该反应的反应速率增大,且平衡向正反应方向移动的是 。
a.及时分离出CO气体 b.适当升高温度
c.增大CO2的浓度 d.选择高效催化剂
(3)能判断该反应已达到化学平衡状态的依据是 。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O),试判断此时的温度为 ℃。
(5)若在(4)所处的温度下,在1L的密闭容器中,加入2molCO2和3molH2充分反应达平衡时,H2的物质的量为 mol,CO的体积分数为 。
在密闭容器里,通入x mol H2(g)和y mol N2(g),发生反应3H2(g)+N 2(g)  2 NH3 (g) △H<0。改变下列条件,反应速率将如何改变?(填“增大”“减小”或“不变”),平衡将如何改变?(填“左”“右”或“不移动”)
2 NH3 (g) △H<0。改变下列条件,反应速率将如何改变?(填“增大”“减小”或“不变”),平衡将如何改变?(填“左”“右”或“不移动”)
(1)升高温度 , ;(2)加入催化剂 , ;
(3)充入更多的H2 , ;(4)扩大容器的体积 , ;
(5)容器容积不变,通入氖气 , 。
反应A(g)+ B(g) C(g) +2D(g)的能量变化如下图所示,回答下列问题。
C(g) +2D(g)的能量变化如下图所示,回答下列问题。
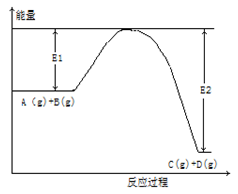
(1)该反应是 反应(填“吸热”“放热”)。
(2)当反应达到平衡时,升高温度,A的转化率 (填“增大”“减小”“不变”下同),原因是 ;
(3)向体系中加入催化剂,△H ;
(4)将1molA和2molB加入2L容器中,5min后达到平衡,此时A的转化率为50%,则5min内用D表示化学反应速率为 ,平衡常数K= 。
材料是人类赖以生存和发展的重要物质基础,铁和碳是生活中常见的材料。
(1)碳可用于制取水煤气:C(s)+H2O(g)=CO(g)+H2(g)。相同温度下,在体积均为2L的两个密闭容器(已加入足量的碳)中进行上述反应,反应容器分别用编号A、B表示。
①写出该反应的平衡常数的表达式:
②已知该温度下平衡常数K="1.5" mol·L-1,若向A容器中另加入一定量的水蒸气,经过一段时间后达到平衡,此时c(H2O)=0.1mol·L-1、c(CO)=0.5mol·L-1,则c(H2)= mol·L-1。
③若向B容器中再加入一定量的水蒸气,某一时刻测得体系中物质的量如下:n(H2O)=0.2mol、n(CO)=0.2mol、 n(H2)=0.8mol则此时该反应
(填“向正方向进行”、“向逆方向进行”或“处于平衡状态”)。
(2)钢铁在海水中常发生电化学腐蚀,其负极反应式为 ;
(3)利用右图装置,可以模拟铁的电化学防护,为减缓铁的腐蚀,若开关K置于b处则Fe应与电源的 极相连。若开关置于a处,则下列可用作X极材料的是 。
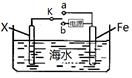
A.Zn B.Cu C.石墨 D.Pt
在2 L的密闭容器内,800℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)(mol) |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)写出该反应的平衡常数表达式:K=______________。已知:K300℃>K350℃,则该反应是______热反应。
(2)下图表示NO2的变化的曲线是__________。用O2表示从0~2 s内该反应的平均速率v=___________。
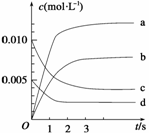
(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是________。
a.及时分离出NO2气体 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂
草酸(H2C2O4)是一种二元弱酸,广泛分布于动植物体中。
(1)人体内草酸累积过多是导致结石(主要成分是草酸钙)形成的原因之一。有研究发现,EDTA(一种能结合金属离子的试剂)在一定条件下可以有效溶解结石,用化学平衡原理解释其原因: 。
(2)已知:0.1 mol·L-1KHC2O4溶液呈酸性。下列说法正确的是 (填字母序号)。
a. 0.1 mol·L-1KHC2O4溶液中:c(K+) + c(H+) = c(HC2O4-) + 2c(C2O42-) + c(OH-)
b. 0.1 mol·L-1 KHC2O4溶液中:c(K+) > c(HC2O4-) > c(C2O42-) > c(H2C2O4)
c. 浓度均为0.1 mol·L-1 KHC2O4和K2C2O4的混合溶液中:2c(K+) = c(HC2O4-) + c(C2O42-)
d. 0.1 mol/L KHC2O4溶液中滴加等浓度NaOH溶液至中性:c(K+) > c(Na+)
(3)利用草酸制备草酸亚铁晶体(FeC2O4·xH2O)的流程及组分测定方法如下:
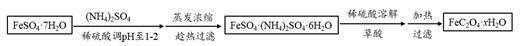
已知:i. pH>4时,Fe2+易被氧气氧化
ii. 几种物质的溶解度(g /100g H2O)如下
| |
FeSO4·7H2O |
(NH4)2SO4 |
FeSO4·(NH4)2SO4·6H2O |
| 20℃ |
48 |
75 |
37 |
| 60℃ |
101 |
88 |
38 |
①用稀硫酸调溶液pH至1~2的目的是: , 。
②趁热过滤的原因是: 。
③氧化还原滴定法常用于测定草酸亚铁晶体的摩尔质量(M)。称取a g草酸亚铁晶体溶于稀硫酸中,用b mol·L-1的高锰酸钾标准液滴定,到达滴定终点时,消耗高锰酸钾VmL,则M = 。(已知:部分反应产物为Mn2+、Fe3+、CO2)
在一定体积的密闭容器中进行某化学反应,其平衡常数表达式为K=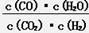 。
。
化学平衡常数K和温度t的关系如下表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学方程式为 。
(2)该反应为 反应(填“吸热”或“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是 (多选扣分)。
A.容器中压强不变 B.混合气体中 c(CO)不变
C.υ正(H2)=υ逆(H2O) D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为
℃。
(5)某温度下,将CO和水蒸气各1mol置于体积为1L的密闭容器中反应,达到平衡后测得CO2为0.5mol,再通入4mol水蒸气,达到新的平衡后CO2的物质的量等于__________mol。
(1)①1 g 硫粉在O2中充分燃烧放出 a kJ热量,写出硫燃烧的热化学方程式 。
②已知25℃时,C2H5OH(l)的燃烧热为1366.8kJ/mol,用热化学方程式表示:
(2)一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线图如下图示,则①在10S内Z的平均速率为 ②该反应的化学方程式 。
在一定条件下,可逆反应A+B mC变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后容器加压的变化情况,问:
mC变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后容器加压的变化情况,问: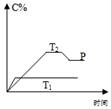
(1)温度T1 _____T2(填大于、等于或小于);
(2)正反应是__________反应(填“吸热”或“放热”);
(3)如果A、B、C均为气体,则m_____2(填大于、等于或小于);
(4)当温度和容积不变时,如向平衡体系中加入一定量的某稀有气体,则体系的压强_____(“增大”、“减小”或“不变”),平衡_______移动;当温度和压强不变时,如在平衡体系中加入一定量的某稀有气体,平衡_______移动(填“向正反应方向”“向逆反应方向”或“不”)。
已知2A2(g)+B2(g) 2C3(g) △H=" -a" kJ•mol-1(a>0),在一个有催化剂的固定容积的容器中加入2molA2和1molB2,在500℃时充分反应达到平衡后C3的浓度为w mol/L,放出热量b kJ;
2C3(g) △H=" -a" kJ•mol-1(a>0),在一个有催化剂的固定容积的容器中加入2molA2和1molB2,在500℃时充分反应达到平衡后C3的浓度为w mol/L,放出热量b kJ;
(1)比较a __________b( 填>、=、<);
(2)若将反应温度升高到700℃,反应的平衡常数将_________(增大、减小或不变);
(3)能说明该反应已经达到平衡状态的是______
a.V(C3)=2V(B2); b.容器内压强保持不变
c.V逆(A2)=2V正(B2) d.容器内的密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是_________
a.及时分离出C3气体; b.适当升高温度; c.增大B2的浓度; d.选择高效的催化剂
研究NO2、SO2、CO等大气污染气体的处理具有重大意义。
(1)NO2可用水吸收,相应的化学反应方程式为_________________________;利用反应6NO2+8NH3═7N2+12H2O也可处理NO2.当转移1.2mol电子时,消耗的NO2在标准状况下是____________L。
(2)已知:
2SO2(g)+O2(g)⇌2SO3(g)△H=-196.6kJ•mol-1
2NO(g)+O2(g)⇌2NO2(g)△H=-113.0kJ•mol-1
则反应NO2(g)+SO2(g)⇌SO3(g)+NO(g)的△H="_______" kJ•mol-1
(3)一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是_______(填序号)
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1mol SO3的同时生成1mol NO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K=_______。
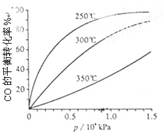
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)═CH3OH(g).CO在不同温度下的平衡转化率与压强的关系如下图所示.该反应△H_____(填“>”或“<”),实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是_______。
试题篮
()