一定量的混合气体在密闭容器中发生反应aA(气)+bB(气) cC(气)+dD(气),达到平衡时测得B气体的浓度为0.6mol·L-1,恒温下将密闭容器的容积扩大1倍,重新达到平衡时,测得B气体的浓度为0.4mol·L-1,下列叙述中正确的是
cC(气)+dD(气),达到平衡时测得B气体的浓度为0.6mol·L-1,恒温下将密闭容器的容积扩大1倍,重新达到平衡时,测得B气体的浓度为0.4mol·L-1,下列叙述中正确的是
| A.a+b>c+d |
| B.重新达到平衡时A的转化率增大 |
| C.平衡向右移动 |
| D.重新达到平衡时D的体积分数减小 |
在容积相同的五个密闭容器中分别放人同量的A2和B2,在不同温度下任其发生反应:A2(g)+2B2(g)2 AB2(g),分别在某时刻测得其中AB3所占的体积分数绘成图,不正确的叙述是
AB2(g),分别在某时刻测得其中AB3所占的体积分数绘成图,不正确的叙述是
| A.反应是放热反应 |
| B.E、F二点尚未达到平衡状态 |
| C.H、I二点尚未达到平衡状态 |
| D.G、H、I三点功能已达平衡状态 |
在高温下,反应2HBr(气) H2(气)+Br2(气)-Q达到平衡时,要使混合气体颜色加深,可采用的方法是
H2(气)+Br2(气)-Q达到平衡时,要使混合气体颜色加深,可采用的方法是
| A.减小压强 |
| B.缩小体积 |
| C.升高温度 |
| D.增大[H2] |
一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示,下列描述正确的是( )
| A.反应开始到10 s,用Z表示的反应速率为0.158 mol·(L·s)-1 |
| B.反应开始到10 s,X的物质的量浓度减少了0.79 mol·L-1 |
| C.反应开始到10 s时,Y的转化率为79.0% |
D.反应的化学方程式为:X(g)+Y(g) Z(g) Z(g) |
可确认发生了化学平衡移动的是( )
| A.化学反应速率发生了改变 |
| B.有气态物质参加的可逆反应达到平衡后,改变了压强 |
| C.由于某一条件的改变,使平衡混合物中各组分的浓度发生了不同程度的改变 |
| D.可逆反应达到平衡后,使用催化剂 |
反应2A(g) 2B(g)+E(g)-Q达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是( )
2B(g)+E(g)-Q达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是( )
| A.加压 | B.减压 |
| C.减小E的浓度 | D.降温 |
如图是温度和压强对X+Y 2Z反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )
2Z反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )
| A.上述可逆反应的正反应为放热反应 |
| B.X、Y、Z均为气体 |
| C.X和Y中只有一种为气态,Z为气态 |
| D.上述反应的逆反应ΔH>0 |
有一化学平衡mA(g)+nB(g) pC(g)+qD(g),如下图所示是A的转化率同压强、温度的关系,分析图象可以得出的正确结论是( )
pC(g)+qD(g),如下图所示是A的转化率同压强、温度的关系,分析图象可以得出的正确结论是( )
| A.正反应吸热,m+n>p+q |
| B.正反应吸热,m+n<p+q |
| C.正反应放热,m+n>p+q |
| D.正反应放热,m+n<p+q |
在一个活塞式的反应容器中,通入2molSO2和1molO2,于500℃下发生化合反应并达到平衡,在保持恒温、恒压的条件下,再通入2molSO2和1molO2,第二次刚通入后反应速率的变化及最终SO3的含量的有关叙述正确的是
| A.V正增大,V逆减小,SO3的百分含量增加 |
| B.V正增大,V逆不变,SO3的百分含量不变 |
| C.V正增大,V逆增大,SO3的百分含量无法判断 |
| D.V正增大,V逆减小,SO3的百分含量保持不变 |
反应NH4HS(s) NH3(g)+H2S(g)在一定温度下达到平衡。下列各种情况下,不能使平衡发生移动的是( )
NH3(g)+H2S(g)在一定温度下达到平衡。下列各种情况下,不能使平衡发生移动的是( )
| A.温度、容积不变时,通入SO2气体 | B.移走一部分NH4HS固体 |
| C.容积不变,充入氮气 | D.充入氮气,保持压强不变 |
在一定温度下的定容密闭容器中,当物质的下列物理量不再变化时,表明反应:
A(s)+2B(g) C(g)+D(g)已达平衡的是( )
C(g)+D(g)已达平衡的是( )
| A.混合气体的压强 | B.混合气体的密度 |
| C.B的物质的量浓度 | D.气体的总物质的量 |
对于反应2SO2+O2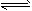 2SO3,下列判断正确的是
2SO3,下列判断正确的是
| A.2体积2SO2和足量O2反应,必定生成2体积SO3 |
| B.其他条件不变,增大压强,平衡必定向右移动 |
| C.平衡时,SO2消耗速度必定等于O2生成速度的两倍 |
| D.平衡时,SO2浓度必定等于O2浓度的两倍 |
对于反应2X(g)+Y(g) 2Z(g)不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量n(Z)和反应时间t的关系如下图所示,下列判断正确的是( )
2Z(g)不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量n(Z)和反应时间t的关系如下图所示,下列判断正确的是( ) 
| A.T1<T2,p1<p2,正反应为放热反应 |
| B.T1<T2,p1>p2,正反应为吸热反应 |
| C.T1>T2,p1>p2,正反应为放热反应 |
| D.T1>T2,p1<p2,正反应为吸热反应 |
试题篮
()