下列情况不能用勒夏特列原理解释的是
| A.生活中,用饱和碳酸钠溶液洗去锅碗瓢盆上的油污,且热溶液的效果更好 |
| B.常温下,铁、铝在浓硝酸中钝化 |
| C.侯氏制碱中,降温析出副产品NH4Cl之前,向溶液中既洒NaCl固体又通入足量NH3 |
| D.夏天,打开冰镇汽水瓶,立即冒出大量泡沫 |
已知图一表示的是可逆反应CO(g)+H2(g) C(s)+H2O(g)△H>0的化学反应速率与实践的关系,图二表示的是可逆反应2NO2(g)
C(s)+H2O(g)△H>0的化学反应速率与实践的关系,图二表示的是可逆反应2NO2(g) N2O4(g) △H<0的浓度随时间的变化情况。下列说法中正确的是( )
N2O4(g) △H<0的浓度随时间的变化情况。下列说法中正确的是( )
| A.图一t2时改变的条件可能是升高了温度或增大了压强 |
| B.图一t2时改变的条件一定是增大了反应物的浓度 |
| C.图二t1时改变的条件可能是升高了温度或增大了压强 |
| D.若图二t1时改变的条件是增大压强,则混合气体的平均相对分子质量将减小 |
NO和CO都是汽车尾气中的有害物质,它们能缓慢地起反应,反应的化学方程式为:
2CO+2NO=N2+2CO2,为了控制大气污染,下列措施切实可行的是( )
| A.改变压强 | B.提高温度 |
| C.使用催化剂 | D.用耐高压储气罐收集尾气,集中处理 |
对于化学反应的限度的叙述不正确的是( )
| A.任何可逆反应都有一定的限度 |
B.对于反应2SO2(g)+O2(g) 2SO3(g)只有达到限度时才有2v(O2)=v(SO3) 2SO3(g)只有达到限度时才有2v(O2)=v(SO3) |
C.对于反应2SO2(g)+O2(g) 2SO3(g)达到限度时,增大容器容积能减小正反应速率 2SO3(g)达到限度时,增大容器容积能减小正反应速率 |
| D.化学反应达到限度时,正逆反应速率相等 |
图像能直观地反映有关物理量的变化及规律,下列各图像与描述相符的是




图1 图2 图3 图4
| A.图1表示SO2氧化反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| B.图2表示0.1 mol MgCl2·6H2O在空气中充分加热时固体质量随时间的变化 |
| C.图3表示分别稀释1 mL pH=2的盐酸和醋酸时溶液pH的变化,图中b>100mL |
D.图4表示平衡2NO2(g) N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化 N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化 |
氯化铁和硫氰化钾在溶液中存在下列平衡:Fe3+(aq)+3SCN-(aq) Fe(SCN)3(aq),某氯化铁和硫氰化钾的混合溶液中,Fe(SCN)3的物质的量浓度与温度T的关系如图所示(曲线上任何一点都表示平衡状态),下列说法不正确的是( )
Fe(SCN)3(aq),某氯化铁和硫氰化钾的混合溶液中,Fe(SCN)3的物质的量浓度与温度T的关系如图所示(曲线上任何一点都表示平衡状态),下列说法不正确的是( )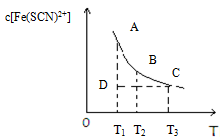
| A.FeCl3(aq)与KSCN(aq)反应的热化学反应方程式为:Fe3+(aq)+SCN-(aq)=Fe(SCN)2+(aq) △H>0 |
| B.温度为T1、T2时,反应的平衡常数分别为K1、K2,则K1<K2 |
| C.反应处于D点时,一定有V正>V逆 |
| D.A点与B点相比,A点的c(Fe3+)大 |
下列有关说法错误的是
| A.室温下的某NaF溶液中,c(H+)=1×10-10 mol∙L-1,说明NaF使水的电离减弱 |
| B.Mg在空气中燃烧时发出耀眼的白光,一部分化学能转化为光能 |
| C.纯碱溶于热水中去污效果增强,说明纯碱的水解是吸热反应 |
| D.反应 N2(g)+3H2(g)=2NH3(g)(△H<0)达平衡后,降低温度,正、逆反应速率都减小,平衡向正反应方向移动 |
在容积不变的密闭容器中,一定条件下发生反应:2A(?) B(g)+C(s),达到化学平衡后,升高温度,容器内气体的密度增大,则下列叙述正确的是( )
B(g)+C(s),达到化学平衡后,升高温度,容器内气体的密度增大,则下列叙述正确的是( )
| A.若正反应是吸热反应,则A为非气态 |
| B.若正反应是放热反应,则A为非气态 |
| C.在平衡体系中加入少量C,该平衡向逆反应方向移动 |
| D.改变压强对该平衡的移动一定无影响 |
将2molA与2molB混合于2L的密闭容器中发生如下反应:2A(g)+3B(g) 2C(g)+zD(g),2s后A的转化率为50%,测得v(D)=0.25mol•L-1•s-1,下列推断不正确的是( )
2C(g)+zD(g),2s后A的转化率为50%,测得v(D)=0.25mol•L-1•s-1,下列推断不正确的是( )
A.v(C)=v(D)=0.25mol•L-1•s-1 B.z=2
C.C的体积分数为28.6% D.B的转化率为25%
中科院大气研究所研究员张仁健课题组与同行合作,对北京地区PM2.5有6个重要来源,其中,汽车尾气和燃煤分别占4%、18%。用于净化汽车尾气的反应为2NO(g)+2CO(g) 2CO2(g)+N2(g),已知该反应在570K时平衡常数为1×1059,但反应很慢。下列说法正确的是( )

| A.装有尾气净化装置的汽车排出的气体中不再含有NO或CO |
| B.提高尾气净化效率的常用方法是升高温度 |
| C.增大压强,上述平衡右移,故实际操作中可通过增压的方式提高其净化效率 |
| D.提高尾气净化效率的最佳途径是使用高效催化剂 |
在一密闭容器中进行如下反应:3H2(气)+N2(气) 2NH3(气),已知反应过程中某一时 刻 H2、N2、NH3的浓度分别为 0.3mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是( )
2NH3(气),已知反应过程中某一时 刻 H2、N2、NH3的浓度分别为 0.3mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是( )
| A.H2为 0.6mol/L、N2为 0. 2mol/L | B.NH3为 0.25mol/L |
| C.N2、NH3均为 0.15mol/L | D.NH3为 0.4mol/L |
可逆反应2SO2 (g)+ O2 (g) 2SO3(g)达到平衡的标志是
2SO3(g)达到平衡的标志是
① 消耗2 mol SO2的同时生成2 mol SO3
②SO2、O2与SO3的物质的量之比为2∶1∶2
③ 反应混合物中,SO3的质量分数不再改变
| A.①② | B.①③ | C.只有③ | D.只有① |
对于反应2CO(g)+ O2(g) 2CO2(g)(ΔH<0),在一定条件下建立化学平衡后,下列各条件变化时,能使平衡向正方向移动的是
2CO2(g)(ΔH<0),在一定条件下建立化学平衡后,下列各条件变化时,能使平衡向正方向移动的是
| A.恒容通入少量He | B.恒容通入少量CO2 |
| C.升高温度 | D.缩小容器体积 |
下列各物质的颜色变化不是由平衡移动引起的是( )
| A.H2、I2、HI平衡混合气体加压颜色变深 |
| B.氯水光照颜色变浅 |
| C.NO2、N2O4混合气体加热颜色变深 |
| D.FeCl3和KSCN的混合溶液中加入FeCl3固体,溶液颜色加深 |
在其他条件不变时,下列说法正确的是( )
| A.增大压强一定会破坏气体反应的平衡状态 |
| B.升高温度可使化学平衡向放热的方向移动 |
| C.使用催化剂只能改变反应速率,不能改变化学平衡状态 |
| D.增大反应物浓度或减小生成物浓度,平衡向逆反应方向移动 |
试题篮
()