向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g) 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别用下表和下图表示:
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别用下表和下图表示:
| 容器 |
甲 |
乙 |
丙 |
| 容积 |
1L |
1L |
2L |
| 温度 |
T1 |
T2 |
T2 |
| 反应物 起始量 |
1molA 2molB |
1molA 2molB |
4molA 8molB |

下列说法正确的是
A.由图可知:T1<T2,且该反应为吸热反应
B.T1时该反应的平衡常数K=7.2
C.前10min甲、乙、丙三个容器中A的反应速率:v(A)甲=v(A)乙<v(A)丙
D.平衡时A的质量m:m乙<m甲<m丙
一定条件下将2mol SO2和2mol SO3气体混合于一固定容积的容器中,发生反应:2SO2+O2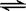 2SO3,平衡时SO3为n mol,在相同温度下,分别按下列配比在上述容器中放入起始物质,平衡时SO3的物质的量可能大于n的是
2SO3,平衡时SO3为n mol,在相同温度下,分别按下列配比在上述容器中放入起始物质,平衡时SO3的物质的量可能大于n的是
| A.2 mol SO2+ 1 mol O2 | B.1mol SO2+ 1 mol O2 |
| C.2 mol SO2+ 1 mol O2+ 2 mol SO3 | D.1 mol SO2+ 1 mol SO3 |
对于密闭容器中的反应:N2(g)+3H2(g) 2NH3(g),在673K、30MPa下,n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述正确的是
2NH3(g),在673K、30MPa下,n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述正确的是

| A.NH3在点a’的正反应速率比点b’的正反应速率更小 |
| B.点c反应达到平衡 |
| C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样 |
| D.点e处c(NH3)不再变化 |
PCl3和PCl5都是重要的化工原料。将PCl3(g)和Cl2(g)充入体积不变的2 L密闭容器中,在一定条件下发生下述反应,并于10 min时达到平衡:PCl3(g)+Cl2(g)  PCl5(g) △H<0。有关数据如下:
PCl5(g) △H<0。有关数据如下:
| |
PCl3(g) |
Cl2(g) |
PCl5(g) |
| 初始浓度/(mol/L) |
2.0 |
1.0 |
0 |
| 平衡浓度/(mol/L) |
(1.6)c1 |
(0.6)c2 |
0.4 |
下列判断不正确的是( )
A.10 min内,v(Cl2)=0.04 mol/(L·min)
B.当容器中Cl2为1.2 mol时,反应达到平衡
C.升高温度,反应的平衡常数减小,则平衡时PCl3的转化率变大
D.平衡后移走2.0 mol PCl3和1.0 mol Cl2,在相同条件下再达平衡时,
c(PCl5)<0.2 mol/L
一定温度下,在三个体积均为1.0L的恒容密闭容器中,充入一定量的H2和SO2发生下列反应:
3H2(g)+SO2(g) 2H2O(g)+H2S(g)
2H2O(g)+H2S(g)
| 容器编号 |
温度/℃ |
起始物质的量/mol |
平衡物质的量/mol |
||
| H2 |
SO2 |
H2 |
SO2 |
||
| 容器I |
300 |
0.3 |
0.1 |
/ |
0.02 |
| 容器II |
300 |
0.6 |
0.2 |
/ |
/ |
| 容器III |
240 |
0.3 |
0.1 |
/ |
0.01 |
下列说法正确的是
A.该反应正反应为吸热反应
B.容器II达到平衡时SO2的转化率比容器I小
C.容器III达到平衡的时间比容器I短
D.240℃时,该反应的平衡常数为1.08×104L• mol-1
已知某可逆反应 mA(g)+ nB(g)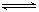 pC(g),在密闭容器中进行,下图表示在 不同反应时间 t、温度 T 和压强 P 与反应物 B 在混合气体中的百分含量 B%的关系曲线,由曲线分析,下列判断正确的是( )
pC(g),在密闭容器中进行,下图表示在 不同反应时间 t、温度 T 和压强 P 与反应物 B 在混合气体中的百分含量 B%的关系曲线,由曲线分析,下列判断正确的是( )

| A.T1<T2、P1>P2、m+n>p,△H <0; |
| B.T1>T2、P1<P2、m+n>p,△H >0; |
| C.T1>T2、P1<P2、m+n<p,△H >0; |
| D.T1<T2、P1>P2、m+n<p,△H <0; |
在一密闭容器中加入A、B、C三种气体,保持一定温度,在t1~t4时刻测得各物质的浓度如下表.据此判断下列结论正确的是
| 测定时刻/s |
t1 |
t2 |
t3 |
t4 |
| c(A)/(mol/L) |
6 |
3 |
2 |
2 |
| c(B)/(mol/L) |
5 |
3.5 |
3 |
3 |
| c(C)/(mol/L) |
1 |
2.5 |
3 |
3 |
A.在t3时刻反应已经停止
B.A的转化率比B的转化率低
C.在容器中发生的反应为:2A+B⇌2C
D.在t2~t3内A的平均反应速率为:[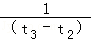 ]mol/(L•s)
]mol/(L•s)
下列相关实验能达到预期目的的是( )
| |
相关实验 |
预期目的 |
| A |
相同温度下,将等质量的大理石块、大理石粉末分别加入等体积、等浓度的盐酸和醋酸中,观察气泡产生的快慢 |
验证固体接触面积对化学反应速率的影响 |
| B |
可逆反应FeCl3(aq)+3KSCN(aq) Fe(SCN)3(aq)+3KCl(aq)建立平衡后,在其它条件不变时,加入KCl固体,观察体系颜色的变化 Fe(SCN)3(aq)+3KCl(aq)建立平衡后,在其它条件不变时,加入KCl固体,观察体系颜色的变化 |
验证浓度对化学平衡的影响 |
| C |
室温下,向BaSO4悬浊液中加入饱和Na2CO3溶液,过滤后,再向沉淀中加入盐酸,沉淀部分溶解 |
验证BaSO4和BaCO3Ksp的相对大小 |
| D |
相同温度下,两支试管中装有等体积、等浓度的H2O2溶液,向其中分别加入少量FeCl3固体和少量的MnO2固体 |
验证不同催化剂对H2O2分解速率的影响 |
相同温度下,相同体积的甲、乙两容器,保持体积不变,甲容器中充入1g SO2和1g O2,乙容器中充入2g SO2和2g O2。下列叙述错误的是( )
| A.化学反应速率:乙>甲 | B.平衡时O2的浓度:乙>甲 |
| C.平衡时SO2的转化率:乙>甲 | D.平衡时SO2的体积分数:乙>甲 |
将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s) 2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示。
2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示。
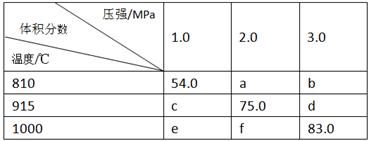
①a<54 ;②该反应的ΔS>0 ;③ 915℃、2.0MPa时E的转化率为60%;
④ 该反应ΔH<0;⑤ K(1000℃)>K(810℃);
上述①~④中正确的有( )
| A.5个 | B.4个 | C.3个 | D.2个 |
下图所示与对应叙述相符的是( )
A.一定条件下,X和Y反应生成Z,由图1推出该反应的方程式可表示为:X + 3Y Z Z |
| B.图2表示NaOH溶液滴加到0.1 mol/L的一元酸溶液得到的滴定曲线(常温下),该实验最好选取酚酞作指示剂 |
| C.常温下,向NaOH溶液中逐滴加入等浓度的醋酸溶液,所得滴定曲线如图3所示。当7<pH<13时,溶液中c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| D.用硝酸银溶液滴定等浓度的A-、B-、C-的混合溶液(均可以与Ag+反应生成沉淀),由图4可确定首先沉淀的是C- |
将可逆反应:2NO2←→2NO+O2在固定容积的密闭容器中进行,达到平衡的标志是
①单位时间内消耗n mol O2的同时,生成2n mol NO2
②单位时间内生成n mol O2的同时,消耗2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1的状态
④混合气体的密度不再改变的状态
⑤混合气体的颜色不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
| A.①④⑥ | B.②③⑤ | C.①③④ | D.②⑤⑥ |
在1升密闭容器中,加入5 mol A物质,在一定条件下同时发生下列两个反应:(1)2A(g) 2B(g)+C(g);(2)A(g)
2B(g)+C(g);(2)A(g) C(g)+D(g)。当达到平衡时,测得c(A)="2.5" mol·L-1,c(C)="2.0" mol·L-1。则下列说法中正确的是:
C(g)+D(g)。当达到平衡时,测得c(A)="2.5" mol·L-1,c(C)="2.0" mol·L-1。则下列说法中正确的是:
A.达到平衡时A的总转化率为40%
B.达到平衡时c(B)为1.0 mol·L-1
C.达到平衡时c(B)=2c(D)
D.达到平衡时c(D)为0.5 mol·L-1
已知图一表示的是可逆反应CO(g)+H2(g)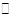 C(s)+H2O(g) ΔH>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)
C(s)+H2O(g) ΔH>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)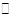 N2O4(g)ΔH<0的浓度(c)随时间(t)的变化情况。下列说法正确的是
N2O4(g)ΔH<0的浓度(c)随时间(t)的变化情况。下列说法正确的是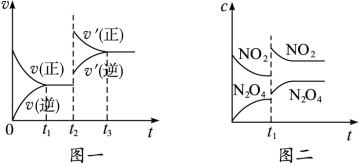
| A.图一的t2时刻和和图二的t1时刻改变的条件都有可能是升高了温度或增大了压强 |
| B.若图二t1时改变的条件是增大压强,则混合气体的平均相对分子质量将减小 |
| C.图一表示在新条件下达到平衡时,v′(正)>v′(逆),图二表示在新条件下达到平衡时,v′(正)<v′(逆) |
| D.其它条件不变,分别使用不同催化剂上述反应的平衡常数均不变 |
试题篮
()