已知一定条件下:A2B5(g)  A2B3(g)+B2(g) A2B3(g)
A2B3(g)+B2(g) A2B3(g)  A2B(g)+B2(g)在容积为2L的密闭容器中,将4 mol A2B3加热至t℃达平衡后, A2B3浓度为0.5 mol/L,A2B5浓度为0.7 mol/L,则t℃时,B2平衡浓度是
A2B(g)+B2(g)在容积为2L的密闭容器中,将4 mol A2B3加热至t℃达平衡后, A2B3浓度为0.5 mol/L,A2B5浓度为0.7 mol/L,则t℃时,B2平衡浓度是
| A.0.1mol/L | B.0.2mol/L | C.0.9mol/L | D.1.5 mol/L |
在恒温、恒容下,发生如下反应:2A(g)+2B(g) C(g)+3D(g),现从两条途径分别建立平衡。途径Ⅰ:A、B的起始浓度均为2mol/L;Ⅱ途径:C、D的起始浓度分别为2mol/L和6mol/L。以下叙述正确的是
C(g)+3D(g),现从两条途径分别建立平衡。途径Ⅰ:A、B的起始浓度均为2mol/L;Ⅱ途径:C、D的起始浓度分别为2mol/L和6mol/L。以下叙述正确的是
A.达平衡时,途径Ⅰ的反应速率V(A)等于途径Ⅱ的反应速率V(A)
B.达平衡时,途径Ⅰ所得混合气的浓度和途径Ⅱ所得混合气体的浓度相等
C.两途径最终达到平衡时,体系内混合气体的百分组成不同
D.两途径最终达到平衡时,体系内混合气体的百分组成相同
T℃时,在容积为2L的3个恒容密闭容器中发生反应:3A(g)+B(g) xC(g),按不同方式投入反应物,测得反应达到平衡时的有关数据如下:
xC(g),按不同方式投入反应物,测得反应达到平衡时的有关数据如下:
| 容器 |
甲 |
乙 |
丙 |
| 反应物投入量 |
3mol A、2mol B |
6mol A、4mol B |
2mol C |
| 到达平衡的时间(min) |
5 |
|
8 |
| A的浓度(mol/L) |
c1 |
c2 |
|
| C的体积分数 |
w1 |
|
w3 |
| 混合气体密度(g/L) |
ρ1 |
ρ2 |
|
下列说法正确的是
A.若x<4,则2c1>c2
B.若x=4,则w3=w1
C.无论x的值是多少,均有2ρ1=ρ2
D.容器甲达到平衡所需的时间比容器乙达到平衡所需的时间短
可逆反应2A(g) B(g)(△H<0)从反应开始至建立平衡后改变某一外界条件(外界条件指的是温度、压强、浓度和催化剂)使平衡发生了移动至新的平衡,该过程中各物质的浓度(用c表示)随时间变化情况如下图所示,试分析各图,指出导致平衡移动的因素和平衡移动的方向:
B(g)(△H<0)从反应开始至建立平衡后改变某一外界条件(外界条件指的是温度、压强、浓度和催化剂)使平衡发生了移动至新的平衡,该过程中各物质的浓度(用c表示)随时间变化情况如下图所示,试分析各图,指出导致平衡移动的因素和平衡移动的方向:

平衡移动的因素:①升高温度 ②降低温度 ③增大压强 ④减小压强
⑤减小生成物B的浓度 ⑥增加反应物的浓度
平衡移动的方向:①正反应方向移动 ②逆反应方向移动 ③不移动
| 序号 |
平衡移动的因素(填序号) |
平衡移动的方向(填序号) |
| A |
|
|
| B |
|
|
| C |
|
|
| D |
|
|
如图所示,甲容器容积固定不变,乙容器有可移动的活塞。甲中充入2 mol SO2和1mol O2,乙中充入4 mol SO3和1mol He,在恒定温度和相同的催化剂条件下,发生如下反应:2SO3(g)  2SO2(g)+ O2 (g)。下列有关说法正确的是
2SO2(g)+ O2 (g)。下列有关说法正确的是
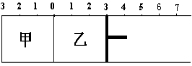
| A.若活塞固定在6处不动,达平衡时甲乙两容器中的压强:P乙=P甲 |
| B.若活塞固定在3处不动,达平衡时甲乙两容器中SO3的浓度: c(SO3)乙>2c(SO3)甲 |
| C.若活塞固定在3处不动,达平衡时甲乙容两器中SO2的体积分数:ψ(SO2)乙>2ψ(SO2)甲 |
| D.若活塞固定在7处不动,达平衡时两容器中SO3的物质的量分数相等 |
一定温度下,在一个体积可变的密闭容器中加入2 mol N2和2 mol H2,建立如下平衡:N2(g)+3H2(g) 2NH3(g)相同条件下,若向容器中再通入1 mol N2和1 mol H2,又达到平衡。则下列说法正确的是
2NH3(g)相同条件下,若向容器中再通入1 mol N2和1 mol H2,又达到平衡。则下列说法正确的是
| A.NH3的百分含量不变 | B.N2的体积分数增大 |
| C.H2的转化率增大 | D.NH3的百分含量增大 |
在某恒容的密闭容器中,可逆反应A(g)+B(g) xC(g)有如图所示的关系曲线,下列说法正确的是
xC(g)有如图所示的关系曲线,下列说法正确的是
| A.温度:T1>T2 | B.压强:p1>p2 |
| C.正反应是放热反应 | D.x的值是2 |
已知:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=﹣49.0kJ•mol﹣1。一定条件下,向体积为1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如下图所示。下列叙述中正确的是
A.升高温度能使 增大 增大 |
| B.反应达到平衡状态时,CO2的平衡转化率为75% |
| C.3 min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率 |
| D.从反应开始到平衡,H2的平均反应速率υ(H2)="0.075" mol•L-1•min-1 |
向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g)⇌SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如右所示.由图可得出的正确结论是( )
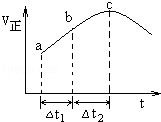
| A.反应在C点达到平衡状态 |
| B.反应物浓度:a点小于B点 |
| C.反应物的总能量低于生成物的总能量 |
| D.△t1=△t2时,SO2的转化率:a~B段小于B~C段 |
一定温度下,在三个体积约为1.0L的恒容密闭容器中发生反应:2CH3OH(g) CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
| 容器编号 |
温度(℃) |
起始物质的量(mol) |
平衡物质的量(mol) |
|
| CH3OH(g) |
CH3OCH3(g) |
H2O(g) |
||
| I |
387 |
0.20 |
0.080 |
0.080 |
| Ⅱ |
387 |
0.40 |
|
|
| Ⅲ |
207 |
0.20 |
0.090 |
0.090 |
下列说法正确的是( )
A.该反应的正方应为吸热反应
B.若起始时向容器I中充入CH3OH 0.1mol、CH3OCH3 0.15mol和H2O 0.10mol,则反应将向正反应方向进行
C.容器I中反应达到平衡所需时间比容器Ⅲ中的长
D.达到平衡时,容器I中的CH3OH体积分数比容器Ⅱ中的小
在25℃下,已知反应:①NH3·H2O+H+ NH4+ + H2O(平衡常数为K1);
NH4+ + H2O(平衡常数为K1);
②Ag++2 NH3·H2O Ag(NH3)2++ 2H2O(平衡常数为K2),且K1> K2。下列说法不合理的是
Ag(NH3)2++ 2H2O(平衡常数为K2),且K1> K2。下列说法不合理的是
A.25℃时,将0.02 mol·L-1的氨水与a mol·L-1的盐酸等体积混合(体积变化忽略不计),反应后溶液呈中性,则用含a的代数式表示NH3·H2O的电离常数为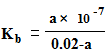 |
| B.往银氨溶液中加水稀释,反应②平衡向逆反应方向移动 |
| C.若往银氨溶液中加入足量的盐酸,则溶液中会产生白色浑浊 |
| D.已知:H+(aq)+ OH-(aq)=H2O(l)DH = -57.3 kJ·mol-1,则1 L 0.1 mol ·L-1氨水和足量的盐酸反应放出的热量等于5.73 kJ |
试题篮
()