在温度、容积相同的三个密闭容器中发生反应N2(g)+3H2(g) 2NH3(g)
2NH3(g)
△H=﹣92.4kJ/mol,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 |
甲 |
乙 |
丙 |
| 反应物投入量 |
1molN2、3molH2 |
2molNH3 |
4molNH3 |
| NH3的浓度(mol/L) |
c1 |
c2 |
c3 |
| 反应的能量变化 |
放出a kJ |
吸收b kJ |
吸收c kJ |
| 体系压强 |
P1 |
P2 |
P3 |
| 反应物转化率 |
α1 |
α2 |
α3 |
| |
|
|
|
下列说法正确的是
A.2 c1>c3 B. a+b="92.4" C. 2P1<P3 D. α1+α3=1
铁的氧化物可用于脱除煤气中的H2S,有关反应原理如下:
①Fe3O4(s)+3H2S(g)+H2(g)⇌3FeS(s)+4H2O(g)
②Fe2O3(s)+2H2S(g)+H2(g)⇌2FeS(s)+3H2O(g)
③FeO(s)+H2S(g)⇌FeS(s)+H2O(g)
温度与上述各反应的平衡常数的关系如图所示。下列有关说法正确的是
| A.反应①、②、③中铁的氧化物都是氧化剂 |
| B.反应①、②、③的正反应都是放热反应 |
| C.反应①、②、③中,温度越高H2S的的脱除率越高 |
| D.反应①、②、③中,压强越大H2S脱除率越高 |
下列各表述与示意图一致的是( )

A.图②中曲线表示反应2SO2(g) + O2(g)  2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化 2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化 |
| B.图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化 |
| C.图③表示10 mL 0.01 mol·L-1KMnO4酸性溶液与过量的0.1 mol·L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化 |
D.图④中a、b曲线分别表示反应CH2=CH2 (g) + H2(g) CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化 CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化 |
在密闭容器中进行反应CH4(g)+H2O(g) CO(g)+ 3H2(g)ΔH>0 ,测得c(CH4) 随反应时间(t)的变化曲线如图所示。下列判断正确的是
CO(g)+ 3H2(g)ΔH>0 ,测得c(CH4) 随反应时间(t)的变化曲线如图所示。下列判断正确的是 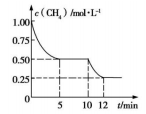
| A.0~5 min 内,v(H2)="0.1" mol·(L·min)-1 |
| B.反应进行到12 min时,CH4的转化率为 25% |
| C.恒温下,缩小容器的体积,平衡后 H2的浓度减小 |
| D.10 min 时,改变的外界条件可能是升高温度 |
对于可逆反应mA(g)+nB(g) pC(g)+gD(g),若其它条件都不变,只是在反应前是否加入催化剂,可得到两种υ~t图象如下图:
pC(g)+gD(g),若其它条件都不变,只是在反应前是否加入催化剂,可得到两种υ~t图象如下图:

如下关系正确的为 ( )
①a1=a2②a1<a2③b1=b2④b1<b2⑤t1>t2⑥t1=t2⑦两图中阴影部分面积相等 ⑧右图阴影部分面积更大
| A.②④⑤⑦ | B.②④⑥⑧ | C.②③⑤⑦ | D.②③⑥⑧ |
密闭容器中,充入一定量的HI气体,发生反应2HI(g) H2(g)+I2(g);ΔH>0,在t1时达到平衡,t2时加热升温并保温,到t3时又达到新平衡,符合这一变化的图像是
H2(g)+I2(g);ΔH>0,在t1时达到平衡,t2时加热升温并保温,到t3时又达到新平衡,符合这一变化的图像是
已知一定条件下:A2B5(g)  A2B3(g)+B2(g) A2B3(g)
A2B3(g)+B2(g) A2B3(g)  A2B(g)+B2(g)在容积为2L的密闭容器中,将4 mol A2B3加热至t℃达平衡后, A2B3浓度为0.5 mol/L,A2B5浓度为0.7 mol/L,则t℃时,B2平衡浓度是
A2B(g)+B2(g)在容积为2L的密闭容器中,将4 mol A2B3加热至t℃达平衡后, A2B3浓度为0.5 mol/L,A2B5浓度为0.7 mol/L,则t℃时,B2平衡浓度是
| A.0.1mol/L | B.0.2mol/L | C.0.9mol/L | D.1.5 mol/L |
如图所示,甲容器容积固定不变,乙容器有可移动的活塞。甲中充入2 mol SO2和1mol O2,乙中充入4 mol SO3和1mol He,在恒定温度和相同的催化剂条件下,发生如下反应:2SO3(g)  2SO2(g)+ O2 (g)。下列有关说法正确的是
2SO2(g)+ O2 (g)。下列有关说法正确的是
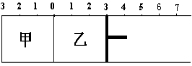
| A.若活塞固定在6处不动,达平衡时甲乙两容器中的压强:P乙=P甲 |
| B.若活塞固定在3处不动,达平衡时甲乙两容器中SO3的浓度: c(SO3)乙>2c(SO3)甲 |
| C.若活塞固定在3处不动,达平衡时甲乙容两器中SO2的体积分数:ψ(SO2)乙>2ψ(SO2)甲 |
| D.若活塞固定在7处不动,达平衡时两容器中SO3的物质的量分数相等 |
在温度相同,压强分别为P1和P2的条件下,A(g)+2B(g) nC(g)的反应体系中,C的百分含量(c%)与时间t的曲线如右图所示,下面结论正确的是( )
nC(g)的反应体系中,C的百分含量(c%)与时间t的曲线如右图所示,下面结论正确的是( )
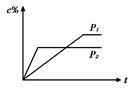
| A.P1>P2,n<3 | B.P1<P2,n>3 |
| C.P1>P2,n>3 | D.P1<P2,n<3 |
在密闭容器中进行下列反应:M(g)+N(g) R(g)+2L,此反应符合下面图像,下列叙述正确的是
R(g)+2L,此反应符合下面图像,下列叙述正确的是

| A.正反应吸热,L是气体 |
| B.正反应吸热,L是固体 |
| C.正反应放热,L是气体 |
| D.正反应放热,L是固体或液体 |
向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g) SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是
SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是
| A.反应在c点达到平衡状态 |
| B.反应物浓度:a点小于b点 |
| C.反应物的总能量高于生成物的总能量 |
| D.△t1=△t2时,SO2的转化率:a~b段大于b~c段 |
体积相同的甲、乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+O2 2SO3,并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率
2SO3,并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率
| A.等于p% | B.大于p% | C.小于p% | D.无法判断 |
下列图示与对应叙述相符合的是
A.图I:反应N2+3H2 2NH3在恒温情况下,反应速率与压强的关系 2NH3在恒温情况下,反应速率与压强的关系 |
B.图Ⅱ:反应H2+I2 2HI达平衡后,升高温度时反应速率随时间的变化 2HI达平衡后,升高温度时反应速率随时间的变化 |
C.图III:反应CO2(g)+H2(g) CO(g)+H2O(g)ΔH>0,水蒸气含量随时间的变化 CO(g)+H2O(g)ΔH>0,水蒸气含量随时间的变化 |
D.图IV:反应2SO2+O2 2SO3达平衡后,缩小容器体积,各成分物质的量随时间的变化 2SO3达平衡后,缩小容器体积,各成分物质的量随时间的变化 |
可逆反应mA(g)十nB(g) pC(g)十qD(g)的v-t图象如下右图,若其它条件不变,只是在反应前加入合适的催化剂,则其v-t图象如图。对于下列命题:
pC(g)十qD(g)的v-t图象如下右图,若其它条件不变,只是在反应前加入合适的催化剂,则其v-t图象如图。对于下列命题:
①a1>a2 ②a1<a2 ③b1>b2 ④b1<b2 ⑤t1>t2 ⑥t1﹦t2 ⑦两图中阴影部分面积相等 ⑧右图中阴影部分面积更大。以上说法中正确的是

| A.②④⑤⑦ | B.①④⑥⑧ | C.②③⑤⑧ | D.①③⑥⑦ |
试题篮
()