下图所示与对应叙述相符的是( )
A.一定条件下,X和Y反应生成Z,由图1推出该反应的方程式可表示为:X + 3Y Z Z |
| B.图2表示NaOH溶液滴加到0.1 mol/L的一元酸溶液得到的滴定曲线(常温下),该实验最好选取酚酞作指示剂 |
| C.常温下,向NaOH溶液中逐滴加入等浓度的醋酸溶液,所得滴定曲线如图3所示。当7<pH<13时,溶液中c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| D.用硝酸银溶液滴定等浓度的A-、B-、C-的混合溶液(均可以与Ag+反应生成沉淀),由图4可确定首先沉淀的是C- |
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)  2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
| 容器 |
甲 |
乙 |
丙 |
| 容积 |
0.5 L |
0.5 L |
1.0 L |
| 温度/℃ |
T1 |
T2 |
T2 |
| 反应物起始量 |
1.5 mol A 0.5 mol B |
1.5 mol A 0.5 mol B |
6.0 mol A 2.0 mol B |
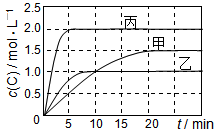
下列说法正确的是
A.10min内甲容器中反应的平均速率v(A)=0.025 mol·L-1·min-1
B.由图可知:T1<T2,且该反应为吸热反应
C.若平衡时保持温度不变,改变容器体积平衡不移动
D.T1℃,起始时甲容器中充入0.5 mol A、1.5 mol B,平衡时A的转化率为25%
已知:4NH3(g)+5O2(g) 4NO(g)+6H2(g) △H= -1025kJ/mol,若反应物起始物质的量相同, 下列关于该反应的示意图不正确的是( )
4NO(g)+6H2(g) △H= -1025kJ/mol,若反应物起始物质的量相同, 下列关于该反应的示意图不正确的是( )

下列图示与对应叙述相符合的是
A.图I:反应N2+3H2 2NH3在恒温情况下,反应速率与压强的关系 2NH3在恒温情况下,反应速率与压强的关系 |
B.图Ⅱ:反应H2+I2 2HI达平衡后,升高温度时反应速率随时间的变化 2HI达平衡后,升高温度时反应速率随时间的变化 |
C.图III:反应CO2(g)+H2(g) CO(g)+H2O(g)ΔH>0,水蒸气含量随时间的变化 CO(g)+H2O(g)ΔH>0,水蒸气含量随时间的变化 |
D.图IV:反应2SO2+O2 2SO3达平衡后,缩小容器体积,各成分物质的量随时间的变化 2SO3达平衡后,缩小容器体积,各成分物质的量随时间的变化 |
将CO2转化为CH4,既可以减少温室气体的排放,又能得到清洁能源。已知:
CO2(g)+2H2O(g) CH4(g)+2O2(g) ΔH=" +802" kJ·mol-1
CH4(g)+2O2(g) ΔH=" +802" kJ·mol-1
右图为在恒温、光照和不同催化剂(Ⅰ、Ⅱ)作用下,体积为1 L的密闭容器中n (CH4)随光照时间的变化曲线。下列说法正确的是
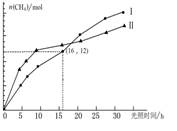
| A.0~25h内,催化剂Ⅰ的催化效果比催化剂Ⅱ的效果好 |
| B.0~16h内,v(H2O)Ⅰ =" 1.5" mol/(L·h) |
| C.在两种不同催化剂下,该反应的平衡常数不相等 |
| D.反应开始后的15h内,第Ⅰ种催化剂的作用下,得到的CH4最多 |
将H2(g)和Br2(g)充入恒容密闭容器,恒温下发生反应H2(g)+Br2(g)  2HBr;△H﹤0,平衡时Br2(g)的转化率为a;若初使条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是( )
2HBr;△H﹤0,平衡时Br2(g)的转化率为a;若初使条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是( )
| A.无法确定 | B.a=b | C.a﹤b | D.a﹥b |
在容积一定的密闭容器中,发生可逆反应:A(g)+B(g) xC(g),有如图(T表示温度,P表示压强,C%表示C的体积分数)所示的反应曲线,则下列说法中正确的是
xC(g),有如图(T表示温度,P表示压强,C%表示C的体积分数)所示的反应曲线,则下列说法中正确的是
| A.x=2,T1>T2,P2>P1 |
| B.P3>P4,y轴表示B的质量分数 |
| C.P3<P4,y轴表示混合气体的密度 |
| D.P3>P4,y轴表示混合气体的平均摩尔质量 |
已知某可逆反应 mA(g)+nB(g)  pC(g) △H=QkJ·mol-1,在密闭容器中进行,下图表示在不同时间t、温度T、压强P与反应物B的百分含量的关系曲线,下列判断正确是
pC(g) △H=QkJ·mol-1,在密闭容器中进行,下图表示在不同时间t、温度T、压强P与反应物B的百分含量的关系曲线,下列判断正确是

| A.T2 >T1,P1 > P2 ,m+n > p,ΔΗ<0 |
| B.T1 >T2,P1 < P2 ,m+n < p,ΔΗ>0 |
| C.T1 <T2,P1 < P2,m+n < p,ΔΗ<0 |
| D.T1 >T2,P1 < P2,m+n > p,ΔΗ>0 |
某温度下,向2 L恒容密闭容器中充入1.0 mol A和1.0 mol B,发生反应:A(g)+B(g)  C(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是( )
C(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是( )

A.反应在前5 s的平均速率v(A)=0.03 mol·L-1·s-1
B.达到平衡时,B的转化率为80%
C.相同温度下,若起始时向容器中充入2.0 mol C,则达到平衡时C的浓度小于0.2 mol·L-1
D.相同温度下,起始时向容器中充入0.20 mol A、0.20 mol B和1.0 mol C,反应达到平衡前v(正)<v(逆)
合成氨工业对国民经济和社会发展具有重要的意义,对于密闭容器中的放热反应:N2(g)+3H2(g) 2NH3(g),673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是( )
2NH3(g),673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是( )
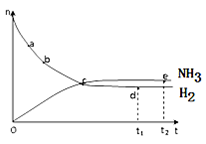
| A.点a的正反应速率比点b的小 |
| B.点 c处反应达到平衡 |
| C.点d(t1时刻)和点 e(t2时刻)处n(N2)不一样 |
| D.其他条件不变,773K下反应至t1时刻,n(H2)比上图中d点的值大 |
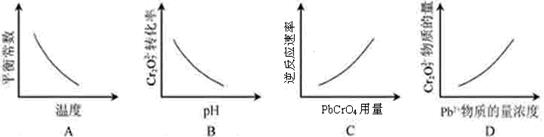
Cr2O72-可通过下列反应转化成铬黄(PbCrO4):
Cr2O72-(aq)+2Pb2+(aq)+H2O(l) 2 PbCrO4(s)+2H+(aq) ΔH< 0
2 PbCrO4(s)+2H+(aq) ΔH< 0
该反应达平衡后,改变横坐标表示的反应条件,下列示意图正确的是( )
在容积为2.0L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图所示,下列条件错误的是
| A.从反应开始到第一次达到平衡时,A物质的平均反应速率为0.067mol/(L·min) |
B.根据图该反应的平衡常数表达式为k=  |
| C.若在第5分钟时升高温度,则该反应的正反应是吸热反应,反应的平衡常数增大,B的反应速率增大 |
| D.若在第7分钟时增加D的物质的量,A的物质的量变化情况符合b曲线 |
在温度一定、2L的恒容密闭容器中,发生3A(g)+B(g)  4C(g)+2D(s)的反应,若最初加入
4C(g)+2D(s)的反应,若最初加入
A和B都是2mol,10s时反应达到平衡,测得υ(A)=0.06mol/(L·S),则下列说法正确的是( )
A.10s时,再加入一定量的D,平衡向右移动
B.10s时用D物质表示的速率为0.04mol/(L·S)
C.10s时,容器中B的浓度为1.6mol·L-1
D.达到平衡时A的转化率为60%,若要在相同条件下反应达到平衡时A的转化率仍为60%,起始
加入n(A)=n(B)即可
某温度下,在一容积可变的容器中,反应2A(g)+B(g) 2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol,保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是( )
2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol,保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是( )
A.均减半 B.均加倍 C.均增加1mol D.均减少1mol
(原创)下列说法不正确的是( )

甲 乙 丙 丁
A.绝热恒容密闭容器中通入A和B,发生反应:2A (g)+B (g)  2C(g),图甲为其正反应速率随时间变化的示意图,则该反应为放热反应。 2C(g),图甲为其正反应速率随时间变化的示意图,则该反应为放热反应。 |
| B.催化剂能降低反应的活化能,提高活化分子的百分含量,从而加快化学反应速率。图乙显示的是催化反应与无催化反应过程中的能量关系。 |
C.将BaO2放入密闭真空容器中,反应2BaO2(s) 2BaO(s)+O2(g)达到平衡时体系压强为P,保持温度不变,t0时刻将容器体积缩小为原来的1/2,体系重新达到平衡,体系压强变化如图丙所示。 2BaO(s)+O2(g)达到平衡时体系压强为P,保持温度不变,t0时刻将容器体积缩小为原来的1/2,体系重新达到平衡,体系压强变化如图丙所示。 |
D.将一定量的NO2充入针筒中后封口,发生反应2NO2 (g) N2O4(g),图丁[表示在拉伸和压缩针筒活塞的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。则c点与a点相比,c(NO2)增大,c(N2O4)增大。 N2O4(g),图丁[表示在拉伸和压缩针筒活塞的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。则c点与a点相比,c(NO2)增大,c(N2O4)增大。 |
试题篮
()