一定温度下的密闭容器中存在如下反应:CO(g) + H2O(g)  CO2(g) + H2(g),已知CO(g)和H2O(g)的起始浓度均为2mol·L-1,经测定该反应在该温度下的平衡常数K=1,试判断:
CO2(g) + H2(g),已知CO(g)和H2O(g)的起始浓度均为2mol·L-1,经测定该反应在该温度下的平衡常数K=1,试判断:
(1) 当CO转化率为25%时,该反应是否达到平衡,若未达到,向哪个方向进行?
(2)当CO的起始浓度仍为2mol·L-1,H2O(g)的起始浓度为6mol·L-1,求平衡时CO的转化率?
t℃时,将3 mol A和1 mol B气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A(g)+B(g) xC(g),2min时反应达到平衡状态(温度不变),剩余了0.8 mol B,并测得C的浓度为0.4 mol/L,请填写下列空白:
xC(g),2min时反应达到平衡状态(温度不变),剩余了0.8 mol B,并测得C的浓度为0.4 mol/L,请填写下列空白:
(1)从开始反应至达到平衡状态,生成C的平均反应速率为 ;
(2)x= ;
(11分)恒温、恒压的条件下,将N2和H2按体积比1:3混合充入一密闭容器中,发生下列反应 N2 + 3 H2 2NH3,达平衡时,测得气体体积为起始气体体积的0.75倍,求:(1)平衡时N2的转化率;
2NH3,达平衡时,测得气体体积为起始气体体积的0.75倍,求:(1)平衡时N2的转化率;
(2)平衡时混合气体中NH3的体积分数;
(3)平衡时混合气体的相对分子质量与起始气体的相对分子质量之比.
(请写出计算过程)
已知CO(g)+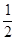 O2(g)=CO2(g),△H ="-283" kJ/mol;H2(g)+
O2(g)=CO2(g),△H ="-283" kJ/mol;H2(g)+ 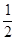 O2(g)=H2O(l),△H ="-285.8" kJ/mol;取CO和H2组成的混合气体0.5mol完全燃烧共放出142.34KJ的热量。若将此0.5mol混合气体充入密闭容器中置于900℃下发生 CO(g)+2 H2(g)
O2(g)=H2O(l),△H ="-285.8" kJ/mol;取CO和H2组成的混合气体0.5mol完全燃烧共放出142.34KJ的热量。若将此0.5mol混合气体充入密闭容器中置于900℃下发生 CO(g)+2 H2(g) CH3OH(g),在一定条件下达到平衡。平衡后容器内压强是相同条件下反应前压强的0.8倍,求:
CH3OH(g),在一定条件下达到平衡。平衡后容器内压强是相同条件下反应前压强的0.8倍,求:
(1)反应前混合气体中CO和H2的体积比;
(2)平衡混合气体中CH3OH和H2的物质的量;
(3)达到平衡时CO的转化率。
恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2 (g) + 3 H2(g) 2NH3(g)。
2NH3(g)。
(1)若反应进行到某时刻t时,nt (N2) = 13mol,nt (NH3) = 6mol,计算a的值。
(2)若反应达平衡时,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为25%,计算平衡时H2的物质的量。
在一定温度下,向10 L密闭容器中充入5.2 mol NO2,达到平衡时, c(N2O4)="0.16" mol·L-1。
请计算该温度下此反应的平衡常数K(请用三段式的方法写出计算过程)。
在一固定容积的密闭容器中,a mol/LN2和b mol/L H2反应,一定条件下经过2min达到平衡,生成c mol/L NH3.
求:(1)用H2表示的速率是多少?(2)N2的转化率是多少?
(8分)工业合成氨的反应为N2(g)+3H2(g) 2NH3(g)。设在容积为2.0 L的密闭容器中充入0.60 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为
2NH3(g)。设在容积为2.0 L的密闭容器中充入0.60 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为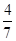 计算:
计算:
(1)该条件下N2的平衡转化率;(小数点后保留一位)
(2)该条件下反应2NH3(g) N2(g)+3H2(g)的平衡常数。(不带单位)
N2(g)+3H2(g)的平衡常数。(不带单位)
在一定条件下,在容积为2L的密闭容器中,将2mol气体M和3mol气体N混合,发生如下反应:2M(g)+ 3N(g)  x Q(g)+3R(g),经2min达平衡,生成2.4molR,并测得Q的浓度为0.4mol/L。求:
x Q(g)+3R(g),经2min达平衡,生成2.4molR,并测得Q的浓度为0.4mol/L。求:
(1)用气体M来表示该反应的化学反应速率是多少?
(2)反应前后的压强比?
(3)N的转化率是多少?
(4)平衡时气体Q所占的体积分数为多少?
某温度下,在装有催化剂的容积为2 L的反应容器中,充入SO2和O2各4 mol ,充分反应5 min后达到平衡,测得反应容器内混合气体的压强为原来的80 %。回答下列问题:
(1)用O2的浓度变化表示该反应的化学反应速率。
(2)求SO2的转化率。
(3)求该反应的平衡常数。
某温度下,在装有催化剂的容积为2 L的反应容器中,充入SO2和O2各4 mol ,充分反应5 min后达到平衡,测得反应容器内混合气体的压强为原来的80 %。回答下列问题:
(1)用O2的浓度变化表示该反应的化学反应速率。
(2)求SO2的转化率。
(3)求该反应的平衡常数。
已知2SO2(g)+ O2(g) 2SO3(g) △H<0,温度一定,体积为3L的密闭容器中,投入2 mol SO2和1 molO2,2min反应达平衡时,容器中有1.2 mol SO3,放出热量118.2kJ,试计算:
2SO3(g) △H<0,温度一定,体积为3L的密闭容器中,投入2 mol SO2和1 molO2,2min反应达平衡时,容器中有1.2 mol SO3,放出热量118.2kJ,试计算:
(要求写计算过程)
(1)写出该反应的热化学方程式。
(2)该反应中SO2的转化率是多少?
(3)反应2分钟,以O2表示的平均反应速率为多少?
(4)计算达平衡后SO2的质量分数为多少?
在2L密闭容器中,充入1 mol N2和3mol H2,一定条件下发生合成氨反应,2min时达到平衡。测得平衡时N2的转化率为40%,求:
(1)平衡时v (NH3)的速率
(2)求该温度下的平衡常数K(列出算式,不用计算出结果)
(3)H2在平衡混合气体中的体积分数
(4)平衡时容器的压强与起始时压强之比
将6mol A气体和5mol B气体混合放入4L密闭容器中,发生下列反应:3A (g) + B (g)  2C (g) + xD (g) ,经过5min达到化学平衡,此时生成C为2mol,测得D的反应速率为0.1mol/(L·min),计算:①、x的值;②、平衡时B的转化率;③、A的平衡浓度;④求平衡常数K。(用三段式的方法写出必要的计算过程,结果精确到小数点后两位)
2C (g) + xD (g) ,经过5min达到化学平衡,此时生成C为2mol,测得D的反应速率为0.1mol/(L·min),计算:①、x的值;②、平衡时B的转化率;③、A的平衡浓度;④求平衡常数K。(用三段式的方法写出必要的计算过程,结果精确到小数点后两位)
(14分)为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要。
(1)汽车内燃机工作时会引起N2和O2的反应:N2 + O2 2NO,是导致汽车尾气中含有NO的原因之一。
2NO,是导致汽车尾气中含有NO的原因之一。
①在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如右图所示,根据图像判断反应N2(g) + O2(g) 2NO(g)的△H________0(填“>”或“<”)。
2NO(g)的△H________0(填“>”或“<”)。
②在T3温度下,向2L密闭容器中充入10molN2与5mo1O2,50秒后达到平衡,测得NO的物质的量为2mol,则该反应的速率υ(N2)=___________________。该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为____________。

(2)利用右图所示装置(电极均为惰性电极)可吸收SO2,用阴极排出的溶液可吸收NO2。
①阳极的电极反应式为_____________________。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应中氧化剂与还原剂的物质的量之比为________。
(3)一定条件下可用甲醇与CO反应生成醋酸消除CO污染。常温下,将a mol/L的醋酸与b mol/L
Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=______________________(用含a和b的代数式表示)。
(4)引起雾霾的PM2.5微细粒子包含(NH4)2SO4、NH4NO3、有机颗粒物及扬尘等,任写一种与SO42-互为等电子体的分子 。
试题篮
()