700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:
CO(g)+H2O(g)  CO2(g)+H2(g)反应过程中测定的部分数据见下表
CO2(g)+H2(g)反应过程中测定的部分数据见下表
| 反应时间/min |
n(CO)/mol |
n(H2O)/ mol |
| 0 |
1.20 |
0.60 |
| t1 |
0.80 |
|
| t2 |
|
0.20 |
依据题意回答下列问题:
(1)反应在t1min内的平均速率为v(H2)= mol·L-1·min-1
(2)若保持其他条件不变,起始时向容器中充入0.60molCO(g)和0.30 molH2O(g),到达平衡时,n(CO2)= mol。
(3)若保持其他条件不变,向平衡体系中再通入H2O(g) 、CO2(g)各0.10mol,达到新平衡时CO2(g)的体积分数为 。
(4)若温度升至800℃,上述反应平衡常数为0.64,则正反应为 反应(填“放热”或“吸热” )。
当前我国环境状况不容乐观,其中PM2.5、CO、S02、NOx等污染物对空气质量的影响非常显著,其主要来源为燃煤、机动车尾气等,因此,对其进行研究具有重要意义。
(1)对某地PM2.5样本用蒸馏水处理后,测得该试样中的化学组分及其平均浓度如下表:

根据表中数据计算该试样的pH=
(2)NOx是汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化如图1所示。
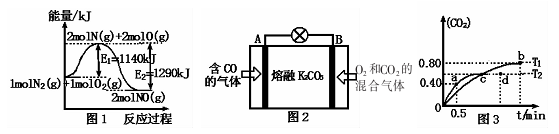
①写出N2和02反应的热化学方程式:________。
②有人设想将C0按下列反应除去:2CO(g)= 2C(s)+02(g)△H>O,请你分析该设想能否实现? (填“是”或“否”),依据是
③用图2所示原电池原理也可以除去CO,则其负极反应式为:________。
(3)有人设想利用反应NaOH+S02=NaHS03将SO2吸收除去,然后用石灰水又可使NaOH再生。再生的离子方程式为: 。
(4)利用I205消除CO污染的反应为:5CO(g)+I205(s)—兰5CO2(g)+I2(s),不同温度下,测得CO2的体积分数随时间t变化曲线如图3.则:
①该反应的化学平衡常数表达式为K=____ 。
②T1与T2化学平衡常数大小关系:K(T1)__________K(T2)(填“>”、“<”或“=”)
硫-氨热化学循环制氢示意图如下:

(1)反应1的离子方程式为 。
(2)反应2能量转化主要方式为 。
(3)反应3中控制反应条件很重要,不同条件下硫酸铵分解产物不同。若在400℃时分解,产物除水蒸气外还有A、B、C三种气体,A是空气中含量最多的单质,B能使湿润的红色石蕊试纸变蓝,C能使品红溶液褪色。则400℃时硫酸铵分解的化学方程式为 。
(4)反应4是由(a)、(b)两步反应组成:
H2SO4(l) =SO3(g) +H2O(g),△H=+177kJ•mol-1 …………(a)
2SO3(g) 2SO2(g) + O2(g),△H="+196" kJ•mol-1…………(b)
2SO2(g) + O2(g),△H="+196" kJ•mol-1…………(b)
①则H2SO4(l)分解为SO2(g)、O2(g)及H2O(g)的热化学方程式为: 。
②在恒温密闭容器中,控制不同温度进行SO3分解实验。以SO3起始浓度均为cmol·L-1,测定SO3的转化率,结果如右图,图中Ⅰ曲线为SO3的平衡转化率与温度的关系,Ⅱ曲线表示不同温度下反应经过相同反应时间且未达到化学平衡时SO3的转化率。

i)图中点X与点Z的平衡常数K:K(X) K(Z)(选填:>,<,=);
ii)Y点对应温度下的反应速率:v(正) v(逆)(选填:>,<,=);
iii)随温度的升高,Ⅱ曲线逼近Ⅰ曲线的原因是: 。
(1)实验测得,8g甲烷在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113kJ的热量,试写出甲烷燃烧的热化学方程式_________________________
(2)在压强为0.1MPa条件下,将amolCO与3amolH2的混合气体在催化剂作用下能自发反应生成甲醇:
CO(g)+2H2(g) CH30H(g)
CH30H(g)
①该反应的△H_____0,___0(填“>”、“<”或“=”)
②若容器容积不变,下列措施可增加甲醇产率的是____________
| A.升高温度 |
| B.将CH3OH(g)从体系中分离 |
| C.充入He,使体系总压强增大 |
| D.再充人lmolCO和3mol H2 |
(3)以CH4和H2O为原料,通过下列反应来制备甲醇。
Ⅰ:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.0kJ•mol-1
Ⅱ:CO(g)+2H2(g)=CH3OH(g)△H=-129.0kJ•mol-1
CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为____________
合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g) 2NH3(g),500 K、30 MPa下n(NH3)、n(H2)和n(N2)随时间变化的关系如图所示。
2NH3(g),500 K、30 MPa下n(NH3)、n(H2)和n(N2)随时间变化的关系如图所示。
请回答下列问题:

(1)上图中属于氢气物质的量随时间变化的曲线是 (填“Ⅰ”、“Ⅱ”或“Ⅲ”)。
(2)关于t2时刻的说法正确的是____________。
A.t2时该反应达到平衡状态
B.t2时Ⅱ和Ⅲ代表的物质反应速率相同
C.t2时氢气、氮气与氨气的反应速率之比为3∶1∶2
D.t2时氨气与氢气的物质的量相同
(3)对于Ⅱ所代表的物质,其逆反应速率最大的点是___________(填“c”、“d”或“g”);对于Ⅰ所代表的物质,其正反应速率最小的点是_____________(填“a”、“e”或“f”)。
(4)其他条件不变,只改变温度,在改变的这个温度下反应至t3时刻,此时n(H2)比图象中的值大,那么该温度可能是 。
A.673 K B.273 K C.373 K
(5)在密闭容器中充入2 mol N2和6 mol H2,一定条件下建立平衡:N2(g)+3H2(g) 2NH3(g) ΔH=-92.2 kJ/mol,测得N2的转化率为90%,则在此条件下,反应放出的热量为 kJ。若与上述反应的温度和体积相同时,向密闭容器中充入4 mol NH3,则达平衡后,反应 (填“放出”或“吸收”)的热量为 kJ。
2NH3(g) ΔH=-92.2 kJ/mol,测得N2的转化率为90%,则在此条件下,反应放出的热量为 kJ。若与上述反应的温度和体积相同时,向密闭容器中充入4 mol NH3,则达平衡后,反应 (填“放出”或“吸收”)的热量为 kJ。
研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH1=+489.0 kJ·mol-1
C(石墨)+CO2(g)="2CO(g)" ΔH2=+172.5 kJ·mol-1
则CO还原Fe2O3的热化学方程式为___________________________
(2)某实验将CO2和H2充入一定体积的密闭容器中,在两种不同温度条件下反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1
测得CH3OH的物质的量随时间变化如图所示,回答问题:

①该反应的平衡常数表达式K=_______________;
②曲线Ⅰ、Ⅱ对应的平衡常数大小关系为:KⅠ _________KⅡ(填“>”、“=”或“<”)。
③下列措施中能增大CO2转化率的是____________。(填序号)
| A.升高温度 | B.充入He(g)使体系压强增大 |
| C.将H2O(g)从体系中分离 | D.再充入一定量CO2 |
④下列图像正确且能表明在t时刻反应一定处于平衡状态的是__________。(填序号)

研究燃料的燃烧和对污染气体产物的无害化处理,对于防止大气污染有重要意义.
(1)将煤转化为清洁气体燃料.已知:
H2(g)+1/2O2(g)=H2O(g) △H=﹣242.0kJ/mol
C(s)+1/2O2(g)=CO(g) △H=﹣110.0kJ/mol
①写出焦炭与水蒸气反应制H2和CO的热化学方程式 ___________________.
②已知在101kPa时,CO、H2和CH4的燃烧热分别为283kJ/mol、286kJ/mol和892kJ/mol.则反应CH4(g)+H2O(g)⇌CO(g)+3H2(g) △H= kJ/mol.
(2)已知一定温度和压强下,由H2和CO反应合成优质燃料甲醇:
CO(g)+2H2(g)⇌CH3OH(g) △H=﹣91kJ/mo1
①在相同条件下要想得到182kJ热量,加入各物质的物质的量可能是 .
| A.2mo1CO和4mol H2 |
| B.2mo1CO、4mol H2和1mol CH3OH(g) |
| C.4mo1CO和4mol H2 |
| D.4mo1CO和6mol H2 |
②将1mol CO和2mol H2充入一密闭容器中,保持恒温恒压时进行反应,达到平衡时,测得CO的转化率为20%.若在相同条件下,起始时在该容器中充入1mol CH3OH(g),反应达到平衡时的热量变化是 (填“吸收”或“放出”) kJ热量.
汽车尾气和燃煤尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为什么2NO+2CO 2CO2+N2。在密闭容器中发生该反应时,随温度(T)和时间(t)的变化曲线如图所示。
2CO2+N2。在密闭容器中发生该反应时,随温度(T)和时间(t)的变化曲线如图所示。
①T1_________(填“>”“<”或“=”)T2。
②在T2温度下,0~2s内的平均反应速率v(N2)=____________________。
③若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是________________。
(2)NH3催化还原氮氧化物(SCR)技术是目前应用广泛的烟气氮氧化物脱除技术。用Fe作催化剂时,在氨气足量的情况下,不同 对应的脱氮率如图所示。
对应的脱氮率如图所示。
脱氮效果最佳的 =________。此时对应的脱氮反应的化学方程式为_______________。
=________。此时对应的脱氮反应的化学方程式为_______________。
(3)NO2、O2和熔融NaNO3可形成燃料电池,其原理如图所示。该电池在使用过程中石墨I电极上生成N2 O5,其电极反应式为_____________。
已知A(g)+B(g)  C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
| 温度/ ℃ |
700 |
800 |
830 |
1000 |
1200 |
| 平衡常数 |
1.7 |
1.1 |
1 |
0.6 |
0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K= ,△H 0(填“<”“ >”“ =”);
(2)830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)="0.003" mol·L-1·s-1,则6s时c(A)= mol·L-1, C的物质的量为 mol;若反应经一段时间后,达到平衡时A的转化率为 ,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为 ;
(3)判断该反应是否达到平衡的依据为 (填正确选项前的字母):
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时问改变 d.单位时间里生成C和D的物质的量相等
(4)1200℃时反应C(g)+D(g)  A(g)+B(g)的平衡常数的值为 。
A(g)+B(g)的平衡常数的值为 。
2015年雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g) 2CO2(g)+N2(g)在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。
2CO2(g)+N2(g)在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。

据此判断:
①该反应的平衡常数表达式为 。
②该反应的ΔH 0(选填“>”、“<”)。
③当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在右图中画出c(CO2)在T2、S2条件下达到平衡过程中的变化曲线。
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
①煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
CH4(g)+2NO2(g) = N2(g)+CO2(g)+2H2O(g) △H =-867kJ·mol-1
2NO2(g)  N2O4(g) △H =-56.9kJ·mol-1
N2O4(g) △H =-56.9kJ·mol-1
写出CH4催化还原N2O4(g)生成N2(g)、CO2(g)和H2O(g)的热化学方程式 。
②将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。下图是通过光电转化原理以廉价原料制备新产品的示意图。

写出上述光电转化过程的化学反应方程式 。催化剂a、b之间连接导线上电子流动方向是 (填a→b或b→a)。
铁可以形成多种氧化物、氢氧化物和盐类。铁与二氧化碳、水在某一密闭体系中反应情况如下表所示:
| 化学反应 |
平衡常数 |
温度 |
|
| 973K |
1173K |
||
| ⅠFe(s)+CO2(g)= FeO(s)+CO(g) |
K1 |
1.47 |
2.15 |
| ⅡFe(s)+H2O(g)= FeO(s)+H2(g) |
K2 |
2.38 |
1.67 |
| ⅢCO(g)+H2O(g)= CO2(g)+H2(g) |
K3 |
? |
? |
完成下列填空:
(1)反应Ⅰ是________(选填“吸热”,“放热”)反应。根据反应Ⅰ与Ⅱ可以推导出同温下K1、K2与K3之间的关系,则K3=________(用K1、K2表示)。
(2)973K时,若反应Ⅲ在一个容积为2L的反应容器内2min时达到平衡,有3mol电子发生转移,则在2min内v(CO2)=__________。若压缩容器的容积为原来的一半,平衡将________移动(选填“向左”,“向右”,“不”),CO2的浓度将________(选填“增大”,“减小”,“不变”)。使该反应的平衡转化率及平衡常数都增大的措施有________。
BCl3是重要的化工原料,其沸点12℃。500℃时,向2L的密闭容器中按一定比例投入B2O3、C、Cl2,模拟工业制取三氯化硼的反应如下:B2O3(s) + 3C(s) + 3Cl2(g)  2BCl3 (g) + 3CO(g)。
2BCl3 (g) + 3CO(g)。
(1)反应起始至3min时固体质量减少了15.9克,则氯气的平均反应速率为_____________。
(2)反应至4min时达到平衡,则下列说法正确的是____________(填序号)。
A.3min时,CO的消耗速率大于氯气的消耗速率
B.2min至4min时BCl3的生成速率比0至2min时的快
C.反应起始至平衡,气体的密度不断增大
D.达到平衡后,容器内的压强不再变化
(3)一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其他有机物)。
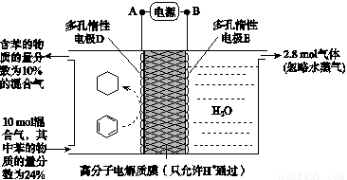
①A、D之间导线中电子移动方向为_______________。(用A、D表示)
②生成目标产物的电极反应式为__________________。
③该储氢装置的电流效率η=____________________。
(η= ×100%,计算结果保留小数点后1位)
×100%,计算结果保留小数点后1位)
大气污染越来越成为人们关注的问题,工业生产尾气中的氮氧化物必须脱除(即脱硝)后才能排放。
(1)已知:
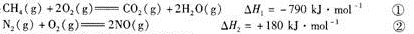
CH4可用于脱硝,其热化学方程式为:

已知反应①中的相关的化学键键能数据如下:

由此计算△H3= kJ·mol-1,C-H化学键键能E= kJ·mol-1。
(2)反应2CO(g) +2NO(g)=N2(g)+2CO2(g)也可用于脱硝,图1为该反应过程中NO的平衡转化率a(NO)与温度、压强的关系[其中初始c(CO)和c(NO)均为1mol.L-1],计算该反应在200cC时的平衡常数K=__ ,图中压强(P1、P2、P3)的大小顺序为_____________。

(3)有人利用电化学方法将CO和NO转化为无毒物质。装置如图2所示
①电极a是 极;②电极b的电极反应式是 。
(4)新型臭氧氧化技术利用具有极强氧化性的0,对尾气中的NO脱除,反应为NO(g)+O3(g)=NO2(g)+O2(g),在一定条件下,将NO和0,通人密闭容器中并不断加热发生反应(温度不超过各物质的分解温度),NO2的体积分数妒(NO2)随时间变化如图3所示,可以发现t1s后NO。的体积分数下降,其可能的原因是__________。研究小组通过增大 比值提高NO的平衡转化率,却发现当
比值提高NO的平衡转化率,却发现当 >1时,NO2的物质的量减小,可能原因是________________。
>1时,NO2的物质的量减小,可能原因是________________。
甲醇是重要的燃料,有广阔的应用前景:工业上一般以CO和为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g) CH3OH(g) △H1=﹣116kJ•mol﹣1
CH3OH(g) △H1=﹣116kJ•mol﹣1
(1)下列措施中有利于增大该反应的反应速率且利于反应正向进行的是___________。
a.随时将CH3OH与反应混合物分离 b.降低反应温度
c.增大体系压强 d.使用高效催化剂
(2)已知:CO(g)+ O2(g)═CO2(g) △H2=﹣283kJ•mol﹣1
O2(g)═CO2(g) △H2=﹣283kJ•mol﹣1
H2(g)+ O2(g)═H2O(g) △H3=﹣242kJ•mol﹣1
O2(g)═H2O(g) △H3=﹣242kJ•mol﹣1
则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为________________________。
(3)在容积为2L的恒容容器中,分别研究在三种不同温度下合成甲醇,右图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为2mol)与CO平衡转化率的关系.请回答:
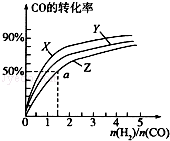
①在图中三条曲线,对应的温度由高到低的顺序是_________________。
②利用a点对应的数据,计算出曲线Z在对应温度下CH3OH(g) CO(g)+2H2(g)的平衡常数:K=_______________。
CO(g)+2H2(g)的平衡常数:K=_______________。
(4)恒温下,分别将1molCO和2molH2置于恒容容器I和恒压容器Ⅱ中(两容器起始容积相同),充分反应.
①达到平衡所需时间是I_________Ⅱ(填“>”、“<”或“=”,下同).达到平衡后,两容器中CH3OH的体积分数关系是I________Ⅱ。
②平衡时,测得容器I中的压强减小了30%,则该容器中CO的转化率为_______。
在一定温度下,10L恒容密闭容器中加入0.05molSO2、0.03molO2,反应为:
2SO2(g)+O2(g)=2SO3(g) ΔH<0,经10min后反应达到平衡,测得C(SO3)=0.004mol/L
(1) SO2的转化率为 ,若在原平衡的基础上再加入0.05molSO2、0.03molO2达到平衡时,SO2的转化率将 (填增大、减小或不变)
(2) 用SO2表示该反应的反应速率为
(3) 平衡时容器内气体压强与反应前的压强之比 (最简整数比)
(4) 平衡时体系中SO3的百分含量(体积分数)
(5) 平衡常数K= ;升高温度K将 (填增大、减小或不变);假如某时刻时SO2为0.02mol,该反应向 (填正向、逆向或不)移动。
试题篮
()