“洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了高热值的煤炭气,其主要成分是CO和H2。CO和H2可作为能源和化工原料,应用十分广泛.生产煤炭气的反应之一是:C(s)+H2O(g) CO(g)+H2(g) H=+131.4kJ/mol
CO(g)+H2(g) H=+131.4kJ/mol
(1)在容积为3L的密闭容器中发生上述反应,5min后容器内气体的密度增大了0.12g/L,用H2O表示0~5min的平均反应速率为______________。
(2)关于上述反应在化学平衡状态时的描述正确的是___________.
A.CO的含量保持不变
B.v正(H2O)=v正(H2)
C.容器中混合气体的平均相对分子质量保持不变
(3)若上述反应在t0时刻达到平衡(如图),在t1时刻改变某一条件,请在图中继续画出t1时刻之后正反应速率随时间的变化:
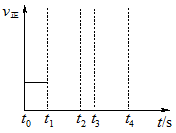
①缩小容器体积,t2时到达平衡(用实线表示);
②t3时平衡常数K值变大,t4到达平衡(用虚线表示).
(4)在一定条件下用CO和H2可以制得甲醇,CH3OH和CO的燃烧热分别为725.8kJ/mol,283.0kJ/mol,1molH2O(l)变为H2O(g)吸收44.0 kJ的热量,写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式_______________________
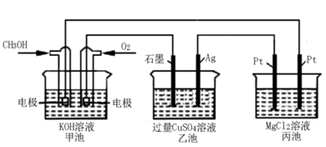
(5)如下图所示,以甲醇燃料电池作为电源实现下列电解过程.乙池中发生反应的离子方程式为_____________。当甲池中增重16g时,丙池中理论上产生沉淀质量的最大值为_________g。
车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”。活性炭可处理大气污染物NO。在5 L密闭容器中加入NO和活性炭(假设无杂质),一定条件下生成气体E和F。当温度分别在T1和T2时,测得各物质平衡时物质的量(n/mol)如下表:
| 物质 T/℃ |
活性炭 |
NO |
E |
F |
| 初始 |
3.000 |
0.10 |
0 |
0 |
| T1 |
2.960 |
0.020 |
0.040 |
0.040 |
| T2 |
2.975 |
0.050 |
0.025 |
0.025 |
(1)写出NO与活性炭反应的化学方程式 ;
(2)计算上述反应T1℃时的平衡常数K1= ;
(3)上述反应T1℃时达到化学平衡后再通入0.1molNO气体,则达到新化学平衡时NO的转化率为 ;
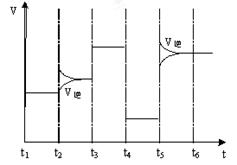
(4)右图为在T1℃达到平衡后在t2、t3、t4、t5时改变某一个反应条件,平衡体系中反应速率随时间变化的情况,且所改变的条件均不同。已知t3-t4阶段为使用催化剂。请判断该反应△H 0(填“>”或“<”)。
化学反应原理在生产和科研中有重要的应用,请利用相关知识回答下列问题。
I.常温下I2O5(s)可用于检测CO,反应原理为:5CO(g)+I2O5(s)  5CO2(g)+I2(s) △H<0.一定温度下,向2L恒容密闭容器中加入足量I2O5(s),并通入1molCO。反应中CO2的体积分数φ(CO2)随时间的变化如图所示:
5CO2(g)+I2(s) △H<0.一定温度下,向2L恒容密闭容器中加入足量I2O5(s),并通入1molCO。反应中CO2的体积分数φ(CO2)随时间的变化如图所示:

(1)该反应的平衡常数表达式K=__________;
(2)0~0.5min内的平均反应速率v(CO)=_________;
(3)下列叙述能说明反应达到平衡的是( )
A.容器内压强不再变化
B.CO的质量不再变化,CO2的转化率不再增大
C.CO2的生成速率等于CO的消耗速率,反应物不再转化为生成物
D.混合气体的平均相对分子质量不再改变
(4)保持温度和体积不变,若开始加入CO(g)的物质的量是原来的2倍,则下列说法正确的是( )
A.平衡时生成I2的质量为原来的2倍
B.达到平衡的时间为原来的2倍
C.平衡时混合气体的物质的量为原来的2 倍
D.平衡时混合气体的密度不变
II.一定条件下在密闭容器中加入NH4I发生反应:A.NH4I(s) NH3(g)+HI(g),
NH3(g)+HI(g),
B.2HI(g)  H2(g)+I2(g)。达到平衡后,扩大容器体积,反应b 的移动方向___________(填正向、逆向或不移动);
H2(g)+I2(g)。达到平衡后,扩大容器体积,反应b 的移动方向___________(填正向、逆向或不移动);
III.己知:2NO2 N2O4 △H<0,将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是( )
N2O4 △H<0,将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是( )

A.b点的操作是压缩注射器
B.c点与a点相比,c(NO2)增大,c(N2O4)减小
C.若反应在一绝热容器中进行,则b、c两点的平衡常数Kb>Kc
D.d点:v(正)>v(逆)
大气污染越来越成为人们关注的问题,烟气中的NOx必须脱除(即脱硝)后才能排放。
(1)已知:CH4(g)+2O2(g)===CO2(g)+2H2O(1) ΔH=-890.3 kJ·mol-1
N2(g)+O2(g)==="2NO(g)" ΔH=+180 kJ·mol-1
CH4可用于脱硝,其热化学方程式为:CH4(g)+4NO(g)=CO2(g)+2N2(g)+2H2O(1),ΔH=________。
(2)C2H4也可用于烟气脱硝。为研究温度、催化剂中Cu2+负载量对NO去除率的影响,控制其它条件一定,实验结果如图1所示。为达到最高的NO去除率,应选择的反应温度和Cu2+负载量分别是___________________________。

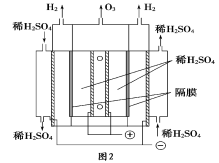
(3)臭氧也可用于烟气脱硝。
①O3氧化NO 结合水洗可产生HNO3和O2,该反应的化学方程式为______________。
②一种臭氧发生装置原理如图2所示。阳极(惰性电极)的电极反应式为___________。
(4)如图3是一种用NH3脱除烟气中NO的原理。

①该脱硝原理中,NO最终转化为________(填化学式)和H2O。
②当消耗2molNH3和0.5molO2时,除去的NO在标准状况下的体积为_____________。
(5)NO直接催化分解(生成N2与O2)也是一种脱硝途径。在不同条件下,NO的分解产物不同。在高压下,NO在40 ℃下分解生成两种化合物,体系中各组分物质的量随时间变化曲线如图4所示。写出Y和Z的化学式: _____________________________。
(1)人们常用催化剂来选择反应进行的方向,左图所示为一定条件下1molCH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去].
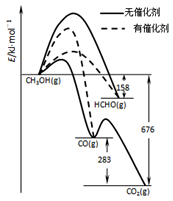
①写出1moL HCHO与O2发生反应时生成CO和H2O(g)的热化学方程式_______________;
②CH3OH与O2在有催化剂作用下反应,产物中HCHO比率大大提高的原因是_______________;
(2)①一定温度下,将N2H4与NO2以体积比为1:1置于10L定容容器中发生反应2N2H4(g)+2NO2(g) 3N2(g)+4H2O(l)△H<0,下列能说明反应达到平衡状态的是_______;
3N2(g)+4H2O(l)△H<0,下列能说明反应达到平衡状态的是_______;
A.混合气体密度保持不变 B.2v正(NO2)=3v逆(N2)
C.N2H4与NO2体积比保持不变 D.体系压强保持不变
②在某温度下,10L密闭容器中发生上述反应,容器内部分物质的物质的量变化如下表:
| 物质的量/mol 时间 |
n (N2H4) |
n (NO2) |
n (N2) |
| 起始 |
2.0 |
3.0 |
0 |
| 第2min |
1.5 |
a |
0.75 |
| 第4min |
1.2 |
b |
1.2 |
| 第6min |
1.0 |
c |
1.5 |
| 第7min |
1.0 |
c |
1.5 |
ⅰ前2min内NO2的平均反应速率为_____________(保留2位有效数字,下同)该温度下反应的平衡常数K=___________________。
ⅱ关于上述反应,下列叙述不正确的是_____________。
A.达到平衡时,移走部分N2,平衡将向右移动,正反应速率加快
B.缩小容器的体积,平衡向右移动,c(N2H4)将变大
C.在相同条件下,若使用甲催化剂能使正反应速率加快105倍,使用乙催化剂能使逆反应速率加快108倍,应选用乙催化剂
D.若保持平衡时的温度和压强不变,再向容器中充入He,则此时v(逆) >v(正)
ⅲ.请画出该反应中n(NO2)随时间变化曲线,并画出在第7min分别升温、加压、加催化剂的情况下n(NO2)随时间变化示意图如图(在图上注明变化的条件)。
甲醇是一种很好的燃料,工业上可用多种原料通过不同的反应制得甲醇.
(1)已知在常温常压下:
CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=﹣442.8kJ•mol﹣1
2CO(g)+O2(g)=2CO2(g)△H=﹣566.0kJ•mol﹣1
H2O(g)=H2O(l)△H=﹣44.0kJ•mol﹣1
则2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=
(2)已知C(s)+H2O(g)=CO(g)+H2(g) ΔH=akJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH=-220kJ·mol-1
H-H、O=O和O-H键的键能分别为436、496和462kJ·mol-1,则a为____________________
(3)工业上正在研究利用来生产甲醇燃料的方法,该反应为:
CO2(g)+3H2(g)⇌ CH3OH(g)+H2O(g)△H=﹣49.0kJ•mol﹣1
在某温度下,将6mol CO2和8mol H2充入容积为2L的密闭容器中,8分钟时达平衡状态,H2的转化率为75%.请回答:
①用CH3OH表示该反应在0﹣8min内的平均反应速率v(CH3OH)= .
②此温度下该反应平衡常数K= ;
(4)一氧化碳与氢气也可以合成甲醇:CO(g)+2H2(g)⇌CH3OH(g)△H<0
①若该反应在恒温恒容条件下进行,下列说法正确的是 ;
a.若混合气体的密度不再改变,说明反应已达化学平衡状态
b.反应达到平衡后,通入CH3OH(g)使压强增大,平衡向右移动
c.反应达到平衡后,通入氩气使压强增大,平衡向右移动
d.反应达到平衡后,升高温度,平衡逆向移动,平衡常数减小
e.若使用催化剂,会改变反应的途径,但反应热不变
②某温度下,在一个容积为2L的密闭容器中进行该反应,已知此温度下的平衡常数K=50L2•mol﹣2,反应到某时刻测得各组分的物质的量如下:
| 物质 |
CO |
H2 |
CH3OH |
| 物质的量/(mol) |
0.4 |
0.4 |
0.8 |
请比较此时正、逆反应速率的大小:v正 v逆(填“>”、“<”或“=”).
(1)现有可逆反应.2NO2(g) N2O4(g),△H<0,试根据下列图象判断t2、t3、t4时采取的措施。
N2O4(g),△H<0,试根据下列图象判断t2、t3、t4时采取的措施。
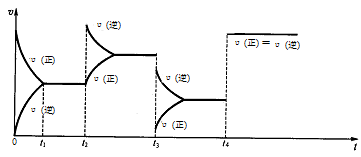
t2: ;
t3: ;t4: 。
在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) C(mol/L) |
0 |
20 |
40 |
60 |
80 |
100 |
| C(N2O4) |
0.20 |
a |
0.10 |
c |
d[] |
e |
| C(NO2) |
0.00 |
0.12 |
b |
0.22 |
0.22 |
0.22 |
(2)40s时,NO2的产率是 。
(3)20s时,N2O4的浓度为 mol/L,0~20s内N2O4的平均反应速率为 。
(4)在80℃时该反应的平衡常数K值为 (保留2位小数)。
(5)在其他条件相同时,该反应的K值越大,表明建立平衡时 。
A、N2O4的转化率越高 B、NO2的产量越大
C、N2O4与NO2的浓度之比越大 D、正反应进行的程度越大
(6)利用甲烷催化还原NOx:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160 kJ/mol
则甲烷直接将NO2还原为N2的热化学方程式为:__ 。
Ⅰ、工业上设计用CO2来生产燃料甲醇,既减少二氧化碳气体,又得到宝贵的能源物质。为了探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1molCO2和3molH2,某温度下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0KJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示
CH3OH(g)+H2O(g)△H=-49.0KJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示

(1)该反应该温度下,化学平衡常数的值为_______________________
(2)下列说法中能作为反应达到平衡状态标志的是___________________(填字母)。
A.容器内压强不再发生变化
B.平均相对分子质量不再变化
C.c(CO2)和c(H2)之比等于1:3
D.相同时间内每断裂3molH-H键,同时断裂3molO-H键
(3)下列措施中能使n(CH3OH)/n(CO2)减小的是__________________
A.再充入1molCO2和3molH2 B.将H2O(g)从体系中分离
C.充入He(g),使体系压强增大 D.升高温度
Ⅱ、钢铁工业是国家工业的支柱,每年钢铁生锈让国家损失大量资金,请回答钢铁腐蚀与防护过程中的有关问题。
(1)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如下:

①A电极对应的金属是_________(写元素名称),B电极的电极反应式是__________;
②若电镀前铁、铜两片金属质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12g,则电镀时电路中通过的电子为__________;
③镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因___________________________。
乙苯催化脱氢制苯乙烯反应: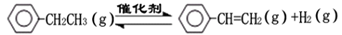
(1)已知:
| 化学键 |
C-H |
C-C |
C=C |
H-H |
| 键能/kJ·molˉ1 |
412 |
348 |
612 |
436 |
计算上述反应的△H=_________ kJ·mol-1。
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应。已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数K=___________________ (用α等符号表示)。
(3)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1︰9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如下: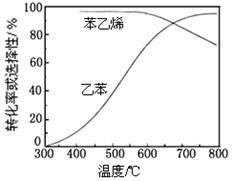
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实 __________________。
②控制反应温度为600℃的理由是____________。
(4)某研究机构用CO2代替水蒸气开发了绿色化学合成工艺——乙苯-二氧化碳耦合催化脱氢制苯乙烯。保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;该工艺中还能够发生反应:CO2+H2=CO+H2O,
CO2+C=2CO。新工艺的特点有_________(填编号)。
① CO2与H2反应,使乙苯脱氢反应的化学平衡右移
② 不用高温水蒸气,可降低能量消耗
③ 有利于减少积炭
④ 有利于CO2资源利用
合成氨是人类科学技术上的一项重大突破,工业上以天然气为原料合成氨。其生产
工艺如下:造气阶段→转化阶段→分离净化→合成阶段
(1)造气阶段的反应为:CH4(g)+H2O(g)  CO(g)+3H2(g) ΔH=+206.1 kJ/mol
CO(g)+3H2(g) ΔH=+206.1 kJ/mol
①在一个密闭容器中进行上述反应, 测得CH4的物质的量浓度随反应时间的变化如下图1所示,10min时,改变的外界条件可能是 。
②如图2所示,在初始容积相等的甲、乙两容器中分别充入等物质的量的CH4和H2O。在相同温度下发生反应,并维持反应过程中温度不变。则达到平衡时,两容器中CH4的转化率大小关系为:α甲(CH4)
α乙(CH4)

(2)转化阶段发生的可逆反应为:CO(g)+H2O(g) CO2(g)+H2(g),在一定温度下,反应的平衡常数为K=1。某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
CO2(g)+H2(g),在一定温度下,反应的平衡常数为K=1。某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
| CO |
H2O |
CO2 |
H2 |
| 0.5 mol |
8.5 mol |
2.0 mol |
2.0 mol |
此时反应中正、逆反应速率的关系式是 (填序号)。
a.v(正)>v(逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断
(3)合成氨反应为:N2(g)+3H2(g) 2NH3(g) ∆H=-92.4kJ/mol,根据勒夏特列原理,简述提高合成氨原料转化率的一种方法 。
2NH3(g) ∆H=-92.4kJ/mol,根据勒夏特列原理,简述提高合成氨原料转化率的一种方法 。
(4)工业合成氨的热化学方程式为N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1。在某压强恒定的密闭容器中加入2mol N2和4mol H2,达到平衡时,N2的转化率为50%,体积变为10 L。求:
2NH3(g) ΔH=-92.4 kJ·mol-1。在某压强恒定的密闭容器中加入2mol N2和4mol H2,达到平衡时,N2的转化率为50%,体积变为10 L。求:
①该条件下的平衡常数为_________;
②若向该容器中加入a mol N2、b mol H2、c mol NH3,且a、b、c 均大于0,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同。反应放出的热量__________(填“>”“<”或“=”)92.4 kJ。
③在一定温度下,在一个容积不变的密闭容器中,发生合成氨反应,下列能判断该反应达到化学平衡状态的是____________
a.v(N2)=3v(NH3)
b.混合气体的密度不随时间改变
c.混合气体的平均相对分子质量不随时间改变
d.容器中的压强不随时间改变
e.c(N2)=c(NH3)
“洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了高热值的煤炭气,其主要成分是CO和H2。CO和H2可作为能源和化工原料,应用十分广泛。生产煤炭气的反应之一是:C (s)+H2O (g)  CO(g)+H2(g) ΔH = +131.4 kJ/mol
CO(g)+H2(g) ΔH = +131.4 kJ/mol
(1)在容积为3 L的密闭容器中发生上述反应,5 min后容器内气体的密度增大了0.12 g/L,用H2O表示0 ~ 5 min的平均反应速率为_________________________。
(2)关于上述反应在化学平衡状态时的描述正确的是 。
A.CO的含量保持不变
B.v正(H2O)= v正(H2)
C.容器中混合气体的平均相对分子质量保持不变
(3)若上述反应在t0时刻达到平衡(如右图),在t1时刻改变某一条件,请在右图中继续画出t1时刻之后正反应速率随时间的变化:
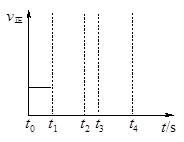
①缩小容器体积,t2时到达平衡(用实线表示);
②t3时平衡常数K值变大,t4到达平衡(用虚线表示)。
(4)在一定条件下用CO和H2可以制得甲醇,CH3OH和CO的燃烧热为别725.8 kJ/mol,283.0 kJ/mol,水的摩尔蒸发焓为44.0 kJ/mol,写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式: 。
(5)如下图所示,以甲醇燃料电池作为电源实现下列电解过程。乙池中发生反应的离子方程式为 。当甲池中增重16 g时,丙池中理论上产生沉淀质量的最大值为 g。
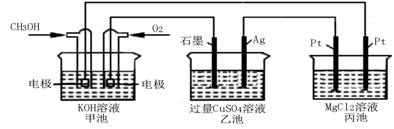
目前正在研究和已经使用的储氢合金有镁系合金、稀土系合金等。
(1)工业上用电解熔融的无水氯化镁获得镁。其中氯化镁晶体脱水是关键工艺之一,一种氯化镁晶体脱水的方法是:先将MgCl2·6H2O转化为MgCl2·NH4C1·nNH3(铵镁复盐),然后在700℃脱氨得到无水氯化镁,脱氨反应的化学方程式为 ____________。
(2)储氢材料Mg(AlH4)2在110~200℃的反应为:Mg(AlH4)2=MgH2+2Al+3H2↑。生成2.7gAl时,产生的H2在标准状况下的体积为______________L。
(3)采用球磨法制备Al与LiBH4的复合材料,并对Al-LiBH4体系与水反应产氢的特性进行下列研究:
①下图为25℃水浴时每克不同配比的Al-LiBH4复合材料与水反应产生H2体积随时间变化关系图。由下图可知,下列说法正确的是_______________(填字母)。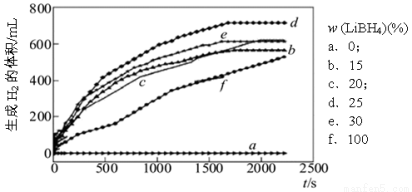
a.25℃时,纯铝与水不反应
b.25℃时,纯LiBH4与水反应产生氢气
c.25℃时,Al-LiBH4复合材料中LiBH4含量越高,1000s内产生氢气的体积越大
②下图为25℃和75℃时,Al-LiBH4复合材料[w(LiBH4)=25%]与水反应一定时间后产物的X-射线衍射图谱(X-射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。
从图中可知,25℃时Al-LiBH4复合材料中与水完全反应的物质是______________(填化学式)。
(4)储氢还可借助有机物,如利用环己烷和苯之间的可逆反应来实现脱氢和加氢: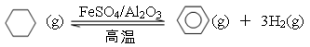
①某温度下,向恒容密闭容器中加入环己烷,起始浓度为a mol·L-1,平衡时苯的浓度为b mol·L-1,该反应的平衡常数K=_______________。
②一定条件下,下图装置可实现有机物的电化学储氢(忽略其它有机物)。生成目标产物的电极反应式为_______________。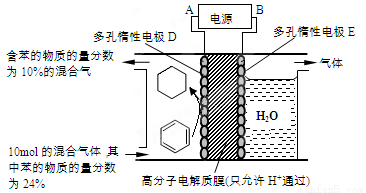
硫一碘循环分解水制氢主要涉及下列反应:
Ⅰ、SO2+2H2O+I2===H2SO4+2HI; Ⅱ、2HI H2+I2; Ⅲ、2H2SO4===2SO2↑+O2↑+2H2O
H2+I2; Ⅲ、2H2SO4===2SO2↑+O2↑+2H2O
(1)分析上述反应,下列判断正确的是 。
a.反应Ⅲ易在常温下进行
b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程中产生1mol O2的同时产生1mol H2
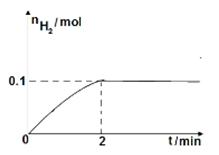
(2)一定温度下,向1L密闭容器中加入1mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。
0~2 min内的平均反应速率v(HI)= 。
(3)实验室用Zn和稀硫酸制取H2,加入少量下列试剂中()产生H2的速率将增大(填字母)。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(4)以H2为燃料可制成氢氧燃料电池。
已知2H2(g)+O2(g)="==" 2H2O(l) △H=-572KJ·mol-1
某氢氧燃料电池释放228.8KJ电能时,生成1mol液态水,该电池的能量转化为 。
(5)利用氢气合成二甲醚的三步反应如下:
①2H2(g) + CO(g)  CH3OH(g);ΔH =-90.8 kJ·mol-1
CH3OH(g);ΔH =-90.8 kJ·mol-1
②2CH3OH(g)  CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
③CO(g) + H2O(g)  CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
总反应:3H2(g) + 3CO(g)  CH3OCH3(g) + CO2 (g)的ΔH=_____ _;
CH3OCH3(g) + CO2 (g)的ΔH=_____ _;
(6)判断该可逆反应达到化学平衡状态的标志是 (填字母)。
a.v生成(CH3OH)= v消耗(CO)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变
d.CO、H2、CH3OH的浓度均不再变化
(7)在某温度下,向一个容积不变的密闭容器中通入2.5mol CO和7.5mol H2反应生成CH3OH(g),达到平衡时CO的转化率为90%,此时容器内的压强为开始时的 倍。
研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)已知拆开1 mol H2、1 mol O2和液态水中1 mol O—H键使之成为气态原子所需的能量分别为436 kJ、496 kJ和462 kJ;CH3OH(g)的燃烧热为627 kJ·mol-1。
则CO2(g)+3H2(g)=CH3OH(g)+H2O(l) ∆H= kJ·mol-1
(2)将燃煤废气中的CO2转化为二甲醚的反应原理为:
2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(l)
CH3OCH3(g)+3H2O(l)
①该反应平衡常数表达式K= 。
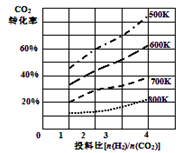
②已知在某压强下,该反应在不同温度、不同投料比时,CO2的转化率如图所示。该反应的∆H 0,(填“>”或“<”)。若温度不变,减小反应投料比[n(H2)/n(CO2)],则K将 (填“增大”、“减小”或“不变”)。
③某温度下,向体积一定的密闭容器中通入CO2(g)与H2(g)发生上述反应,当下列物理量不再发生变化时,能表明上述可逆反应达到化学平衡的是 。
| A.二氧化碳的浓度 | B.容器中的压强 |
| C.气体的密度 | D.CH3OCH3与H2O的物质的量之比 |
(3)向澄清的石灰水中通入CO2至溶液中的Ca2+刚好完全沉淀时,则溶液中c(CO32 -)= 。[已知:Ksp(CaCO3)=2.8×10-9]
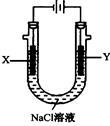
(4)以甲醚、空气、氢氧化钾溶液为原料的燃料电池为电源,以石墨为电极电解500 mL滴有酚酞的NaCl溶液,装置如图所示:请写出电解过程中Y 电极附近观察到的现象 ;当燃料电池消耗2.8L O2(标准状况下)时,计算此时:NaCl溶液的pH= (假设溶液的体积不变,气体全部从溶液中逸出)。
I.(1)对反应N2O4(g) 2NO2(g) △H>0 ,在温度为T1、 T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。T1 T2(填“>”、“<”或“=”);A、C两点的速率VA VC(同上)。
2NO2(g) △H>0 ,在温度为T1、 T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。T1 T2(填“>”、“<”或“=”);A、C两点的速率VA VC(同上)。

(2)在100℃时,将0.400mol的NO2气体充入2L真空定容密闭容器中,
每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间(s) |
0 |
20 |
40 |
60 |
80 |
| n(NO2)/mol |
0.40 |
n1 |
0.26 |
n3 |
n4 |
| n(N2O4)/mol |
0.00 |
0.05 |
n2 |
0.08 |
0.08 |
①该反应的平衡常数K的值为 ;
②若在相同情况下最初向该容器充入的是N2O4,要达到上述同样的平衡状态,N2O4的起始浓度是_____________mol/L。
③计算②中条件下达到平衡后混合气体的平均相对分子质量为 ;(结果保留小数点后一位)
II. 在0.5 L的密闭容器中,一定量的H2和N2进行如下化学反应:3H2(g)+N2(g) 2NH3(g) △H <0,其化学平衡常数K与温度t的关系如下表。请回答下列问题。
2NH3(g) △H <0,其化学平衡常数K与温度t的关系如下表。请回答下列问题。
| t/℃ |
200 |
300 |
400 |
| K |
K1 |
K2 |
0.5 |
④比较K1,K2的大小,K1_________K2(填写“ >”、“=”或“<”)。
⑤在400℃时,当测得NH3和N2、H2的物质的量分别为3mol和1 mol、2 mol时,则该反应的V(H2)正_________ V (H2)逆(填写“>”、“=”或“<”)。
试题篮
()