在一定温度下,10L密闭容器中加入5molSO2、3molO2,反应达平衡时有3molSO2发生了反应。试填写下列空格:
①生成SO3 mol; ②O2的转化率为 ;
③平衡时容器内气体总物质的量为 mol;
④平衡时体系中SO3的百 分含量(体积分数)为 ;
⑤若反应前容器内压强为p1,则平衡时容器内的压强为 (用p1表示)
有两个起始体积相同的密闭容器A和B, A容器有一个可移动的活塞,能使容器内保持恒压;B容器为固定体积。起始时这两个容器分别充入等量的体积比
A容器有一个可移动的活塞,能使容器内保持恒压;B容器为固定体积。起始时这两个容器分别充入等量的体积比
为2 ∶1的SO2和O2的混合气,并使A、B容器中气体体积相等,并保持在
∶1的SO2和O2的混合气,并使A、B容器中气体体积相等,并保持在
400℃条件下发生反应2SO2+O2 2SO3,并达到平衡。
2SO3,并达到平衡。
⑴ 达到平衡所需时间,A容器比B容器_______,两容器中SO2的转化率A比B______。
⑵ 达 到⑴所述平衡后,若向两容器中分别通入数量不多的等量Ar气体,A容器的化学平衡向________移动,B容器的化学平衡________移动
到⑴所述平衡后,若向两容器中分别通入数量不多的等量Ar气体,A容器的化学平衡向________移动,B容器的化学平衡________移动 。
。
⑶ 达到⑴所述平衡后,若向容器中通入等量的原混合气体,重新达到平衡后,A容器中SO3的体积分数________,B容器中SO3的体积分数__________(填变大、变小、不变)。
根据下表所示化学反应与数据关系:
| 化学反应 |
平衡常数 |
温度 |
|
| 973K |
1173K |
||
① |
 |
1.47 |
2.15 |
②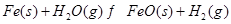 |
 |
2.38 |
1.67 |
③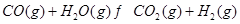 |
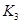 |
? |
? |
请回答:
(1)反应①是 (填“吸热”或“放热”)反应。
(2)根据反应①与②可推导出K1、K2与K3之间的关系,则K3= (用K1、K2表示)。
(3)要使反应③在一定条件下建立的平衡向逆反应方向移动,可采取的措施有 (填写字母序号)。
A 缩小反应容器的容积 B 扩大反应容器的容积 C 升高温度
D 使用合适的催化剂 E 设法减小平衡体系中的CO的浓度
(4)若反应③的逆反应速率与时间的关系如图所示:

①可见反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的是什么条件:t2时 ,t8时 。
②若t4时降压,t6时增大反应物的浓度,请在图中画出 ~
~ 时逆反应速率与时间的关系线。
时逆反应速率与时间的关系线。
反应N2+3H2 2NH3 ⊿H= —92.4 kJ/mol 在一定温度和体积不变的密闭容器中进行并达到平衡,如果最初c (N2 )= 2mol/L,c (H2)=5mol/L,反应达到平衡时有一半的N2发生了反应,则:
2NH3 ⊿H= —92.4 kJ/mol 在一定温度和体积不变的密闭容器中进行并达到平衡,如果最初c (N2 )= 2mol/L,c (H2)=5mol/L,反应达到平衡时有一半的N2发生了反应,则:
(1)求达到平衡时, H2和NH3的浓度分别为c (H2 )= mol/L,c (NH3)=" " mol/L
(2)求平衡时H2的转化率为 ;求平衡时NH3的物质的量与平衡后总物质的量的比值为
(3)求该温度下的平衡常数为 ;达到平衡后,提高温度,则平衡 (填正移,逆移或不移动);K值 ;H2的转化率 (后两个空填增大,减小或不变)
在一个固定容积的密闭容器中,在一定温度下发生下列反应:
A(g)+B(g)→2C(g),起始加入1molA和2molB,反应达到平衡后测得C的浓度为
p mol/L,且C的体积分数为ω。在相同条件下:
(1)若在相同容器中加入2molA和4molB,达平衡后,C的物质的量浓度为_______mol/L;
(2)若在相同容器中加入0.5molC,要求平衡后C的浓度为0.5p mol/L,且C的体积分数为ω,则还应在容器中加入A______mol,B______mol;
(3)若在相同容 器中加入a mol A、b mol B、c mol C,并要求平衡后C的浓度为p mol/L,C的体积分数仍为ω,则a、b、c应符合的关系是__________________________(其中一个只含a和b,另一个只含a和c)。
器中加入a mol A、b mol B、c mol C,并要求平衡后C的浓度为p mol/L,C的体积分数仍为ω,则a、b、c应符合的关系是__________________________(其中一个只含a和b,另一个只含a和c)。
在稀氨水中存在平衡:NH3+H2O NH
NH +OH-,如进行下列操作,则NH3、NH
+OH-,如进行下列操作,则NH3、NH 、H+、OH-浓度及PH值如何变化?(试用“增大”“减小”“不变”填写。)(1)通适量HCl气体时,c(NH3) ,c(H+) ,PH值 。
、H+、OH-浓度及PH值如何变化?(试用“增大”“减小”“不变”填写。)(1)通适量HCl气体时,c(NH3) ,c(H+) ,PH值 。
(2加入少量NaOH固体时,c(NH ) ,c(OH-) ,PH值 。
) ,c(OH-) ,PH值 。
(3)加入NH4Cl晶体时,c(NH ) ,c(OH-) 。
) ,c(OH-) 。
下图表示的是N2 + 3H2 2NH3;△H<0达到平衡后,改变条件建立的新平衡(图中横坐标表示反应时间, 纵坐标表示反应速率)
2NH3;△H<0达到平衡后,改变条件建立的新平衡(图中横坐标表示反应时间, 纵坐标表示反应速率) 

(1)表示减少H2的量而建立新平衡的是 。
(2)表示压缩气体, 体积减小而建立新平衡的是 。
(3)表示降低温度而建立新平衡的是 。
(4)表示升高温度而建立新平衡的是 。
(5)表示加入催化剂后而建立新平衡的是 。
汽车尾气(含烃类、CO、NO与SO2等)是城市主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气生态循环的无毒气体,反应原理:2NO(g)+2CO(g)===N2(g)+2CO2(g),在298 K、100 kPa下,ΔH=-113 kJ/mol,ΔS=-145 J/(mol·K).
(1)为了提高该反应的速率和NO的转化率,采取的正确措施为________.
| A.加催化剂同时升高温度 | B.加催化剂同时增大压强 |
| C.升高温度同时充入N2 | D.降低温度同时增大压强 |
(2)该反应达到平衡时若缩小体积,则混合气体的平均相对分子质量________,若升高温度,则该反应的平衡常数________(均填“增大”、“减小”或“不变”).
(3)该条件下反应__________________(填“能”或“不能”)自发进行.
(4)在如图中画出在某时刻条件改变后的图象(其他条件不变).
t1:增大NO的浓度
t2:降低温度
Ⅰ.在一个容积固定为2L的密闭容器中,发生反应:aA (g) + bB(g)  pC(g) △H=?反应情况记录如下表:
pC(g) △H=?反应情况记录如下表:
| 时间/(min) |
n(A)/( mol) |
n(B)/( mol) |
n(C)/( mol) |
| 0 |
1 |
3 |
0 |
| 第2 min |
0.8 |
2.6 |
0.4 |
| 第4 min |
0.4 |
1.8 |
1.2 |
| 第6 min |
0.4 |
1.8 |
1.2 |
| 第8 min |
0.1 |
2.0 |
1.8 |
| 第9 min |
0.05 |
1.9 |
0.3 |
请根据表中数据仔细分析,回答下列问题:
(1)第2min到第4min内A的平均反应速率V(A)= mol•L-1• min-1
(2)由表中数据可知反应在第4min到第6min时处于平衡状态,若在第2min、第6min、第8 min时分别改变了某一个反应条件,则改变的条件分别可能是:
①第2min 或 ;
②第6min ;
③第8 min 。
(3)若从开始到第4 min建立平衡时反应放出的热量为235.92kJ则该反应的△H= 。
(4)反应在第4 min建立平衡,此温度下该反应的化学平衡常数K= .
Ⅱ.已知:常温下,A酸的溶液pH=a, B碱的溶液pH=b
(1)若A为盐酸,B为氢氧化钡,且a=3,b=11,两者等体积混合,溶液的pH为 。
A.大于7 B.等于7 C. 小于7
(2)若A为醋酸,B为氢氧化钠,且a=4,b=12,那么A溶液中水电离出的氢离子浓度为
mol•L-1,B溶液中水电离出的氢离子浓度为 mol•L-1。
(3)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为:
。
(每空格3分,计18分)工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为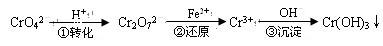
其中第①步存在平衡:2CrO42—(黄色)+2H+ Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显 色.
(2)第②步中,还原1mol Cr2O72—离子,需要________mol的FeSO4·7H2O。
(3)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s) Cr3+(aq)+3OH—(aq)
Cr3+(aq)+3OH—(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH—)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至 。
方法2:电解法
该法用Fe做电极电解含Cr2O72—的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(4)用Fe做电极的阳极反应式为:
。
(5)在阴极附近溶液pH升高的原因是(用电极反应解释) 。溶液中同时生成的沉淀还有 。
向甲乙两个容积均为1 L的恒容容器中,分别充入2 mol A、2 mol B和1 mol A、1 mol B。相同条件下(温度T ℃),发生下列反应:A(g)+B(g) xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示:
xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示:
回答下列问题:
(1)乙容器中,平衡后物质B的转化率________;
(2)x=________;
(3)T ℃时该反应的平衡常数为________;
(4)下列说法正确的是________。
A.向平衡后的乙容器中充入氦气可使c(A)增大
B.将乙容器单独升温可使乙容器内各物质的体积分数与甲容器内的相同
C.若向甲容器中再充入2 mol A、2 mol B,则平衡时甲容器中0.78 mol·L-1<c(A)<1.56 mol·L-1
已知化学反应①:Fe(s)+CO2(g) FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g) FeO(s)+H2(g),其平衡常数为K2。在温度973 K和
FeO(s)+H2(g),其平衡常数为K2。在温度973 K和
1173 K情况下,K1、K2的值分别如下:
| 温度 |
K1 |
K2 |
| 973 K |
1.47 |
2.38 |
| 1173 K |
2.15 |
1.67 |
(1)通过表格中的数值可以推断:反应①是 (填“吸热”或“放热”)反应。
(2)现有反应③:CO2(g)+H2(g) CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3= 。
CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3= 。
(3)能判断反应③已达平衡状态的是 。
A.容器中压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=c(CO)
(4)根据反应①与②可推导出K1、K2与K3之间的关系式 。据此关系式及上表数据,也能推断出反应③是 (填“吸热”或“放热”)反应。要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施是 (填写序号)。
A.缩小反应容器容积 B.扩大反应容器容积
C.降低温度 D.升高温度
E.使用合适的催化剂 F.设法减少CO的量
将固体NH4I置于密闭容器中,某温度下发生下列变化:
NH4I(s)  NH3 (g) + HI(g) 2HI(g)
NH3 (g) + HI(g) 2HI(g)  H2(g) + I2(g)
H2(g) + I2(g)
当反应达到平衡时c (H2)=" 0.5" mol/L, c (HI)=" 4" mol/L, 则 c(NH3) ,HI 的
分解率为 。
在一个体积为2L的密闭容器中,高温下发生下列反应:
Fe(s) + CO2(g) FeO(s) + CO(g) + Q kJ
FeO(s) + CO(g) + Q kJ
其中CO2、CO的物质的量(mol)随时间(min)的变化如图所示。
(1)、反应在1min时第一次达到平衡状态,固体的质量增加了3.2g。用CO的浓度变化表示的反应速率υ(CO)=_________。
(2)、反应进行至2min时,若只改变一个条件,曲线发生的变化如图所示,3min时再次达到平衡,则Q 0(填“>”、“<”或“=”)。第一次平衡与第二次平衡的平衡常数相比,K1 K2。(填“>”、“<”或“=”)。
(3)、5min时再充入一定量的CO(g),平衡发生移动。下列说法正确的是 (填写编号)。
a.υ(正)先增大后减小 b.υ(正)先减小后增大
c.υ(逆)先增大后减小 d.υ(逆)先减小后增大
表示n(CO2)变化的曲线是________(填写图中曲线的字母编号)。
(4)、请用固态物质的有关物理量来说明该反应已经达到化学平衡状态:
______________________________________________________________________。
(10分)痛风是关节炎反复发作及产生肾结石为特征的一类疾病,关节炎的原因归结于在关节滑液中形成了尿酸钠(NaUr)晶体,有关平衡如下:①HUr(尿酸,aq) Ur-(尿酸根,aq)+H+(aq) (37℃时,Ka=4.0×10—6) ②NaUr(s)
Ur-(尿酸根,aq)+H+(aq) (37℃时,Ka=4.0×10—6) ②NaUr(s)  Ur-(aq)+Na+(aq)
Ur-(aq)+Na+(aq)
(1)37°时,1.0 L水中可溶解8.0×10-3mol尿酸钠,此温度下尿酸钠的Ksp为________。
(2)关节炎发作大都在脚趾和手指的关节处,这说明温度降低时,反应②的Ksp________(填“增大”、“减小”或“不变”),生成尿酸钠晶体的反应是________(填“放热”或“吸热”)反应。
(3)37℃时,某病人尿液中尿酸分子和尿酸根离子的总浓度为2.0×10-3mol·L—1,其中尿酸分子的浓度为5.0×10—4mol·L—1,该病人尿液的c(H+)为 ,PH 7(填“>”、“=”或“<”)。
试题篮
()