(13分)合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
N2(g)+3H2(g)  2NH3(g) △H=" -92.4" kJ/mol 据此回答以下问题:
2NH3(g) △H=" -92.4" kJ/mol 据此回答以下问题:
(1)合成氨工业采取的下列措施中,不能用勒沙特列原理解释的是 (填序号)。
①反应压强为20Mpa~50Mpa ②500℃的高温 ③铁触媒作催化剂 ④将生成的氨液化并及时从体系中分离出来,未反应的N2、H2循环到合成塔中。
(2)一定条件下NH3的平衡体积分数随n(N2)变化如图所示(T-温度)。则T2 T1(填>、=、<),判断的依据是: 
(3)合成氨气所需的氢气可以由水煤气分离得到。涉及反应信息如下:
反应一:C(s)+H2O(g)  H2(g)+CO(g) 平衡常数K1
H2(g)+CO(g) 平衡常数K1
反应二:CO(g)+H2O(g)  H2(g)+CO2(g) 平衡常数K2
H2(g)+CO2(g) 平衡常数K2
① K1的表达式:K1=
②将一定量的H2O(g)和CO(g)分别通入到体积为1L的密闭容器中,在不同条件下进行反应,得到以下三组数据:
| 实验组别 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
||
| H2O |
CO |
H2 |
CO |
|||
| 1 |
650 |
1 |
2 |
0.8 |
1.2 |
5 |
| 2 |
900 |
0.5 |
1 |
0.2 |
0.8 |
3 |
| 3 |
T |
a |
b |
c |
d |
t |
(Ⅰ)实验1中,用CO2表示反应开始到平衡的平均反应速率为
(Ⅱ)在实验3,当a=0.5、b=1时,要使c、d数据与实验2相同,且t<3,可以采取的措施为 (填序号)
A.其它条件不变温度T<900℃ B.其它条件不变温度T>900℃
C.充入一定量氖气 D.使用高效催化剂
(Ⅲ)对于反应二,当升高温度时K2 (填“增大”、“减小”或“不变”)。
反应m A+n B p C在某温度下达到平衡。
p C在某温度下达到平衡。
(1)若A、B、C都是气体,减压后正反应速率小于逆反应速率,则m、n、p的
关系是 。
(2)若C为气体,且m + n = p,在加压时化学平衡发生移动,则平衡必定向_____
方向移动。
(3)如果在体系中增加或减少B的量,平衡均不发生移动,则B肯定不能为___态。
(1) 室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失),
①__ _和_ __两种粒子的物质的量之和等于0.1mol。
②_ __和_ __两种粒子的物质的量之和比OH―多0.05mol。 (2)今有a.盐酸 b.硫酸 c.醋酸三种酸:
①在同体积,同pH的三种酸中,分别加入足量的碳酸钠粉末,在相同条件下产生CO2的体积由大到小的顺序是_________________。(填酸的序号,下同)。
②在同体积、同浓度的三种酸中,分别加入足量的碳酸钠粉末,在相同条件下产生CO2的体积由大到小的顺序是_________________。
③物质的量浓度为0.1 mol/L的三种酸溶液的pH由大到小的顺序是___________;如果取等体积的0.1 mol/L的三种酸溶液,用0.1 mol/L的NaOH溶液中和,当恰好完全反应时,消耗NaOH溶液的体积由大到小的顺序是______________。
研究NO2、SO2 、CO等大气污染气体的处理方法具有重要的意义。
(1)已知:2SO2(g)+O2(g) 2SO3(g) ΔH="-196.6" kJ·mol-1
2SO3(g) ΔH="-196.6" kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH="-113.0" kJ·mol-1
2NO2(g) ΔH="-113.0" kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH= kJ·mol-1。
SO3(g)+NO(g)的ΔH= kJ·mol-1。
(2)一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO3的同时生成1 molNO2
若测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K= 。
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。
(1)在250C、101KPa时,3.2克甲醇(CH30H)完全燃烧生成CO2和液态水时放热72.576kJ,则能表示甲醇燃烧的热化学方程式为___________________。
(2)为探究反应原理,现进行如下实验,在体积为2 L的密闭容器中,充入2mol CO2和6mol H2,一定条件下发生反应:CO2(g)+3H2(g)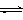 CH3OH(g)+H2O(g) △H=—49kJ/mol,测得CO2和H2O (g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) △H=—49kJ/mol,测得CO2和H2O (g)的浓度随时间变化如图所示。
①从反应开始到平衡,氢气的平均反应速率v(H2)=__________mol/(L·min)。
②下列措施中能使n(H2O)/n(CO2)增大的是________。
A.升高温度 B.再充入3mol H2
C.将CH3OH (g)从体系中分离 D.充入He(g),使体系压强增大
H2A(酸):K1=4.310-6,K2=2.110-9。H2B(酸):K1=1.010-4,K2=6.310-8,在浓度相同的对应溶液中,用“>”、“<”或“=”填空。
(1)中和同浓度、同体积NaOH溶液时的用量:H2A溶液________H2B溶液;
(2)c (Na+):Na2A溶液________Na2B溶液;
(3)pH:H2A溶液________H2B溶液;
(4)酸分子的浓度:NaHA溶液________NaHB溶液;
(5) 酸根离子的浓度:NaHA溶液________NaHB溶液;
温度对化学平衡的影响是通过改变_____________________实现的;催化剂对反应速率的影响是通过减小______________实现的。
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。已知:
SO2(g)+1/2O2(g)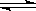 SO3(g)△H=-98 kJ·mol-1。
SO3(g)△H=-98 kJ·mol-1。
(1)某温度下该反应的平衡常数K=10/3,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v(正) v(逆)(填“<”、“>”或“=”)。
(2)一定温度下,向一带活塞的体积为2 L的密闭容器中充入2.0 mol SO2和1.0 mol O2,达到平衡后体积变为1.6 L,则SO2的平衡转化率为 。
(3)在(2)中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的
是 (填字母)。
| A.保持温度和容器体积不变,充入1.0 mol O2 |
| B.保持温度和容器内压强不变,充入1.0 mol SO3 |
| C.降低温度 |
| D.移动活塞压缩气体 |
(4)若以下图所示装置,用电化学原理生产硫酸,写出通入O2电极的电极反应式为 ;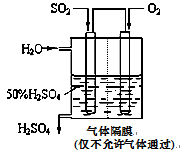
为稳定持续生产,硫酸溶液的浓度应维持不变,则通入SO2和水的质量比为____________ 。
(10分)向一个固定体积的密闭容器充入2 mol A和1 mol B,发生如下反应:
2A(g) + B(g) 3C(g) + D(g),2分钟后,反应达到平衡,C的浓度为1.2 mol/L。
3C(g) + D(g),2分钟后,反应达到平衡,C的浓度为1.2 mol/L。
(1)用A表示2分钟内平均反应速率 ,A在第1分钟平均速率 第2分钟平均速率(填“<”、“>”、“=”)。
(2)器温度升高,平衡时混合气体的平均相对分子质量减小,则正反应为________(填“吸热”或“放热”)反应。
(3)大B的转化率,可采取的措施是_________(用序号填空)
①加入A ②加入B ③加压 ④再加入1.6 mol A+ 0.8 mol B ⑤将C分离出容器
(4)体积可变,维持容器压强和温度不变,按下列方法加入起始物质,达到平衡时C的浓度仍为1.2 mol/L的是_________(用序号填空)
①4 mol A + 2 mol B ②3mol C + 1 mol D + l mol B
③3 mol C + 2 mol D ④1.6 mol A+ 0.8 mol B + 0.6 mol C + 0.2 mol D
研究NO2、SO2 、等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为 。利用反应6NO2+ 8NH3 7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L 。
7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L 。
(2)已知:2SO2(g)+O2(g) 2SO3(g) ΔH =" -" 196.6 kJ· mol-1
2SO3(g) ΔH =" -" 196.6 kJ· mol-1
2NO(g)+O2(g) 2NO2(g) ΔH =" -" 113.0 kJ· mol-1
2NO2(g) ΔH =" -" 113.0 kJ· mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH = kJ· mol-1。
SO3(g)+NO(g)的ΔH = kJ· mol-1。
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO3的同时生成1 molNO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K= 。
物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看做是化学平衡的一种。请根据所学化学知识回答下列问题:
Ⅰ、已知0.01mol/L的NaHCO3溶液呈碱性。
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
① ② 。
(2)溶液中共有 种不同的粒子(指分子和离子)。
(3)该溶液中的离子浓度由大到小的顺序是: 。
(4)向该溶液中加入AlCl3溶液,有白色胶状 沉淀生成,同时产生一种无色无味并能使澄清石灰水变浑浊的气体,写出该反应的离子方程式: 。
沉淀生成,同时产生一种无色无味并能使澄清石灰水变浑浊的气体,写出该反应的离子方程式: 。
Ⅱ、有盐酸、硫酸、醋酸三种溶液,试回答:
(1)若三种溶液的浓度均为0.1 mol•L-1,其c(H+) 依次为a mol•L-1,b mol•L-1,c mol•L-1,其大小顺序为 ;中和一定量NaOH溶液生成正盐时,需上述三种酸的体积依次是V1L、V2L、V3L,其大小关系为 。
(2)若三种溶液的pH都为2,分别取10mL上述溶液加水稀释至1000mL,此时三种溶液的pH1、pH2、pH3之间的关系为 (用“<”、“>”或“=”表示,pH1 ——代表盐酸、 pH2 ——代表硫酸、pH3 ——代表醋酸)
Ⅲ、已知含有足量AgCl固体的饱和溶液中存在如下平衡:AgCl(s) Ag+(aq)+Cl-(aq),且在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl固体分别放入下列液体中:①100mL蒸馏水
Ag+(aq)+Cl-(aq),且在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl固体分别放入下列液体中:①100mL蒸馏水
②100mL0.3mol/L AgNO3溶液 ③100mL0.1mol/L MgCl2溶液充分搅拌后冷却到25℃时,此时c(Ag+)由大到小的顺序为 (填序号),溶液②中c(Cl-)= 。
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上利用煤的汽化产物(水煤气)合成二甲醚。
请回答下列问题:
(1)煤的汽化的主要化学方程式为 。
(2)利用水煤气合成二甲醚的总反应式可表示为3CO(g)+3H2(g) CH3OCH3(g)+CO2(g) △H< 0。一定条件下得密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是 (填字母代号)。
CH3OCH3(g)+CO2(g) △H< 0。一定条件下得密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是 (填字母代号)。
| A.高温高压 | B.加入催化剂 |
| C.减少CO2的浓度 | D.增加CO的浓度 E.分离出二甲醚 |
(3)已知反应2CH3OH(g)  CH3OCH3(g)+H2O(g),某温度下得平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g),某温度下得平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 |
CH3OH |
CH3OCH3 |
H2O |
| 浓度/(mol/L) |
0.44 |
0.6 |
0.6 |
①通过计算比较此时正、逆反应速率的大小?
②若加入CH3OH后,经10min反应达到平衡,试计算此时CH3OH的物质的量浓度和该时间内CH3OH的化学反应速率?
I. 恒温、恒压下,在一个容积可变的容器中发生如下反应: A(g)+B(g)  C(g)
C(g)
(1)若开始时放入1molA和1molB,到达平衡后,生成a mol C,这时A的物质的量
为_____mol。
(2)若开始时放入3molA和3molB,到达平衡后,生成C的物质的量为 mol。
(3)若开始时放入x mol A、2molB和l mol C,到达平衡后,A和C的物质的量分别
是y mol和3a mol,则x ="_____mol," y =_____mol。平衡时,B的物质的量_____(选
填一个编号)。
(甲)大于2mol (乙)等于2mol
(丙)小于2mol (丁)可能大于、等于或小于2mol。
(4)若在(3)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量分数是
________。
II. 若维持温度不变,在一个与(1)反应前起始体积相同、且容积固定的容器中发生上述反应。
(5)开始时放入l mol A和l mol B到达平衡后生成b mol C。将b与(1)小题中的a进
行比较________________ (选填一个编号)。
(甲)a < b (乙) a > b (丙) a =" b " (丁) 不能比较a和b的大小。
在450℃并有催化剂存在下,于一容积恒定的密闭容器内进行下列反应:
2SO2(g)+O2(g) 2SO3(g) △H=―190 kJ·mol—1
2SO3(g) △H=―190 kJ·mol—1
(1)该反应500℃时的平衡常数________450℃时的平衡常数(填“>”、“<”或“=”)。
(2)450℃时,在一2L密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是 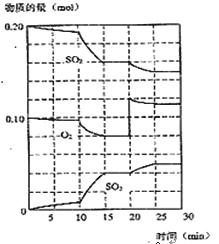
(3)据图判断,反应进行至20min时,曲线发生变化的原因是___________________(用文字表达),10min到15min的曲线变化的原因可能是 (填字母)。
| A.加了催化剂 | B.缩小容器体积 |
| C.降低温度 | D.增加SO3物质的量 |
(4)欲提高SO2的转化率,下列措施可行的是______。
(填字母)
a.向装置中再充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d.升高温度
(5)利用图中数据计算450℃时反应进行至15min时,SO2的平衡转化率为: 。
(6)450℃时,另一2L容积不变的密闭容器中,测得某时刻各物质的量如下:
n(SO2)=0.4mol,n(O2)=0.2mol,n(SO3)=0.8mol,则此时该反应向 进行(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
试题篮
()