高温下,炼铁高炉中存在下列平衡:FeO(s)+CO(g)  Fe(s)+CO2(g) △H>0
Fe(s)+CO2(g) △H>0
试回答下列问题:
⑴铁在元素周期表中位于 ▲ 周期 ▲ 族。
⑵写出该反应的平衡常数表达式: ▲ ,升高温度,该反应的平衡常数K值将
▲ (填“增大”、“减小”或“不变”,下同),平衡体系中固体的质量将 ▲ 。
⑶为减少高炉冶铁时,含有CO的尾气排放,下列研究方向不可取的是 ▲ 。
| A.其它条件不变,增加高炉的高度 | B.调节还原时的炉温 |
| C.增加原料中焦炭与赤铁矿的比例 | D.将生成的铁水 及时移出 及时移出 |
⑷1100℃时, FeO(s)+CO(g)  Fe(s)+CO2(g),平衡常数K=0.4。今在一密闭容器中,加入7.2g的FeO,同时通入4.48L的CO气体(已折合为标准状况),将其升温到1100℃,并维持温度不变,达平衡时,FeO的转化率为 ▲ 。(精确到0.1%)
Fe(s)+CO2(g),平衡常数K=0.4。今在一密闭容器中,加入7.2g的FeO,同时通入4.48L的CO气体(已折合为标准状况),将其升温到1100℃,并维持温度不变,达平衡时,FeO的转化率为 ▲ 。(精确到0.1%)
尿素(H2NCONH2)是一种非常重要的高氮化肥,工业上合成尿素的反应如下:
2NH3(l)+CO2(g) H2O(l)+H2NCONH2 (l) △H=-103.7 kJ·mol-1
H2O(l)+H2NCONH2 (l) △H=-103.7 kJ·mol-1
试回答下列问题:
⑴下列措施中有利于提高尿素的产率的是___________。
A.采用高温 B.采用高压 C.寻找更高效的催化剂
⑵合成尿素的反应在进行时分为如下两步:
第一步:2NH3(l)+CO2(g) H2NCOONH4(氨基甲酸铵) (l) △H1
H2NCOONH4(氨基甲酸铵) (l) △H1
第二步:H2NCOONH4(l) H2O(l)+H2NCONH2(l) △H2
H2O(l)+H2NCONH2(l) △H2
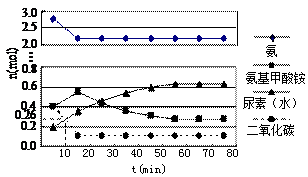 |
某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol 氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如下图Ⅰ所示:
氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如下图Ⅰ所示:
图Ⅰ 图Ⅱ
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第 ▲ 步反应决定,总反应进行到 ▲ mi n时到达平衡。
n时到达平衡。
②反应进行到10 min时测得CO2的物质的量如图所示,则用CO2表示的第一步反应的速率v(CO2)= ▲ 。
③第二步反应的平衡常数K随温度的变化如上右图Ⅱ所示,则△H2 ▲ 0(填“>”“<”或“=”)
(1)对反应N2O4(g) 2NO2(g) △H>0 ,在温度为T1、 T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。T1 T2(填“>”、“<”或“=”);A、C两点的速率vA vC(
2NO2(g) △H>0 ,在温度为T1、 T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。T1 T2(填“>”、“<”或“=”);A、C两点的速率vA vC( 同上)。
同上)。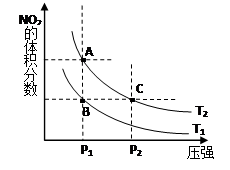
(2)在100℃时,将0.400mol的NO2气体充入2L真空定容密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间(s) |
0 |
20 |
40 |
60 |
80 |
| n(NO2)/mol |
0.40 |
n1 |
0.26 |
n3 |
n4 |
| n(N2O4)/mol |
0.00 |
0.05 |
n2 |
0.08 |
0.08 |
①在上述条件下,从反应开始直至20s时,二氧化氮的平均反应速率为 ;
②该反应的平衡常数K的值为 ;
③若在相同情况下最初向该容器充入的是N2O4,要达到上述同样的平衡状态,N2O4的起始浓度是 mol/L。
④计算③中条件下达到平衡后混合气体的平均相对分子质量为 ;(结果保留小数点后一位)
工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为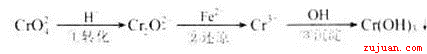
其中第①步存在平衡:2CrO42—(黄色)+2H+ Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显 色.
(2)能说明第①步反应达平衡状态的是 。
a.Cr2O72—和CrO42—的浓度相同 b.2v (Cr2O72—) ="v" (CrO42—) c.溶液的颜色不变
(3)第②步中,还原1mol Cr2O72—离子,需要________mol的FeSO4·7H2O。
( 4 ) 第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s) Cr3+ (aq)+3OH—(aq)
Cr3+ (aq)+3OH—(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH—)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至 。
方法2:电解法
该法用Fe做电极电解含Cr2O72—的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(5)用Fe做电极的原因为 。
(6)在阴极附近溶液pH升高的原因是(用电极反应解释) 。
溶液中同时生成的沉淀还有 。
在一个体积为2L的密闭容器中,高温下发生下列反应:
Fe(s) + CO2(g) FeO(s) + CO(g) + Q kJ
FeO(s) + CO(g) + Q kJ
其中CO2、CO的物质的量(mol)随时间(min)的变化如图所示。
(1)、反应在1min时第一次达到平衡状态,固体的质量增加了3.2g。用CO的浓度变化表示的反应速率υ(CO)=_________。
(2)、反应进行至2min时,若只改变一个条件,曲线发生的变化如图所示,3min时再次达到平衡,则Q 0(填“>”、“<”或“=”)。第一次平衡与第二次平衡的平衡常数相比,K1 K2。(填“>”、“<”或“=”)。
(3)、5min时再充入一定量的CO(g),平衡发生移动。下列说法正确的是 (填写编号)。
a.υ(正)先增大后减小 b.υ(正)先减小后增大
c.υ(逆)先增大后减小 d.υ(逆)先减小后增大
表示n(CO2)变化的曲线是________(填写图中曲线的字母编号)。
(4)、请用固态物质的有关物理量来说明该反应已经达到化学平衡状态:
______________________________________________________________________。
向甲乙两个容积均为1 L的恒容容器中,分别充入2 mol A、2 mol B和1 mol A、1 mol B。相同条件下(温度T ℃),发生下列反应:A(g)+B(g) xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示:
xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示:
回答下列问题:
(1)乙容器中,平衡后物质B的转化率________;
(2)x=________;
(3)T ℃时该反应的平衡常数为________;
(4)下列说法正确的是________。
A.向平衡后的乙容器中充入氦气可使c(A)增大
B.将乙容器单独升温可使乙容器内各物质的体积分数与甲容器内的相同
C.若向甲容器中再充入2 mol A、2 mol B,则平衡时甲容器中0.78 mol·L-1<c(A)<1.56 mol·L-1
在2L密闭容器内,800℃时反应:2NO(g)+O2(g) 2NO2(g)。体系中,n(NO)随时间的变化如表:
2NO2(g)。体系中,n(NO)随时间的变化如表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)(mol) |
0.020 |
0.01. |
0.008 |
0.007 |
0.007 |
0.007 |
(1)写出该反应的平衡常数表达式:K= 。
已知: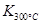 >
>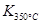 ,则该反应是 热反应。
,则该反应是 热反应。
(2)图中表示NO2的变化的曲线是 。
用O2表示从0~2 s内该反应的平均速率v= 。
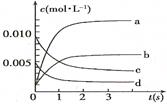
(3)能说明该反应已达到平衡状态的是 。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是 。
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
Ⅰ.在一个容积固定为2L的密闭容器中,发生反应:aA (g) + bB(g)  pC(g) △H=?反应情况记录如下表:
pC(g) △H=?反应情况记录如下表:
| 时间/(min) |
n(A)/( mol) |
n(B)/( mol) |
n(C)/( mol) |
| 0 |
1 |
3 |
0 |
| 第2 min |
0.8 |
2.6 |
0.4 |
| 第4 min |
0.4 |
1.8 |
1.2 |
| 第6 min |
0.4 |
1.8 |
1.2 |
| 第8 min |
0.1 |
2.0 |
1.8 |
| 第9 min |
0.05 |
1.9 |
0.3 |
请根据表中数据仔细分析,回答下列问题:
(1)第2min到第4min内A的平均反应速率V(A)= mol•L-1• min-1
(2)由表中数据可知反应在第4min到第6min时处于平衡状态,若在第2min、第6min、第8 min时分别改变了某一个反应条件,则改变的条件分别可能是:
①第2min 或 ;
②第6min ;
③第8 min 。
(3)若从开始到第4 min建立平衡时反应放出的热量为235.92kJ则该反应的△H= 。
(4)反应在第4 min建立平衡,此温度下该反应的化学平衡常数K= .
Ⅱ.已知:常温下,A酸的溶液pH=a, B碱的溶液pH=b
(1)若A为盐酸,B为氢氧化钡,且a=3,b=11,两者等体积混合,溶液的pH为 。
A.大于7 B.等于7 C. 小于7
(2)若A为醋酸,B为氢氧化钠,且a=4,b=12,那么A溶液中水电离出的氢离子浓度为
mol•L-1,B溶液中水电离出的氢离子浓度为 mol•L-1。
(3)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为:
。
将0.8 mol I2(g)和1.2 mol H2(g)置于某1L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)  2HI(g)并达到平衡。HI的体积分数随时间的变化如表格所示:
2HI(g)并达到平衡。HI的体积分数随时间的变化如表格所示:
| HI体积分数 |
1min |
2min |
3min |
4min |
5min |
6min |
7min[ |
| 条件I |
26% |
42% |
52% |
57% |
60% |
60% |
60% |
| 条件II |
20% |
33% |
43% |
52% |
57% |
65% |
65% |
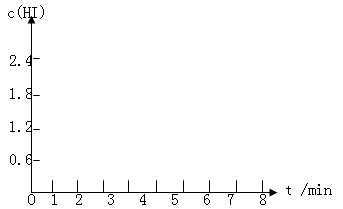
(1)在条件I到达平衡时,计算该反应的平衡常数K,要求列出计算过程。
(2)在条件I从开始反应到到达平衡时,H2的反应速率为____________。
(3)为达到条件II的数据,对于反应体系可能改变的操作是_______________。
(4)该反应的△H__________0(填">","<"或"=")
(5)在条件I下达到平衡后,在7min时将容器体积压缩为原来的一半。请在图中画出c(HI)随时间变化的曲线。
哈伯因发明了氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖, 。右图表示某温度时,向1L容器中加入1mol氮气,3mol氢气,该反应在110S内反应进行的程度:
。右图表示某温度时,向1L容器中加入1mol氮气,3mol氢气,该反应在110S内反应进行的程度: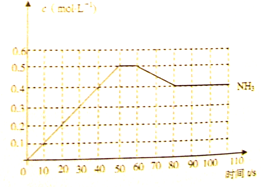
(1)此反应在50~60s时化学平衡常数为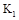 = (列出计算式不用试算)。
= (列出计算式不用试算)。
(2)反应进行到60s时,改变的条件可能是 。
| A.加入催化剂 | B.扩大容器的体积 |
| C.升高温度 | D.减小氨气的浓度 |
在该条件下,氮气的化学反应速率 (填“变小”、“变大”或“不变”)
(3)该反应在80S后化学平衡常数为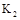 ,则
,则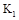
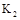 (填“>”,“<”或“=”),此时氮气的转化率为 。
(填“>”,“<”或“=”),此时氮气的转化率为 。
(4)若在110s后向该平衡体系中再加入1mol氨气,则再次达平衡后,氨气在平衡体系中的体积分数 。(填“变小”、“变大”或“不变”)
甲醇是一种可再生能源,在日常生活中有着广泛的应用.工业上用CO生产燃料甲醇,如:CO(g)+2H2(g)⇌CH3OH(g).图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化.
请回答下列问题:
(1)图1表示使用和未使用催化剂时反应过程和能量的对应关系.下列有关催化剂的说法不正确是
| A.降低分子的能量 | B.增加了活化分子数 |
| C.提高了活化分子百分数 | D.增加了单位体积内的活化分子数 |
(2)从反应开始到建立平衡,该过程中释放 kJ热量.
(3)在T2℃下,将2molCO和6molH2充入2L的密闭容器中,达到平衡状态时,测得c(CO)=0.2mol•L﹣1,则CO的转化率为 .
(4)如图3为常用笔记本电脑所用甲醇质子交换膜燃料电池的结构示意图如.电池总反应为2CH3OH+3O2⇌2CO2+4H2O.在电脑的使用过程中,电池的温度往往因为各种原因会升高.温度升高_____________(填:“有利于”或“不利于”)电池将化学能转化为电能.该装置中___________(填:“a”或“b”)为电池的负极,该电极反应式为 .
工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有还原沉淀法,该法的工艺流程为:
其中第①步存在平衡:2CrO42—(黄色)+2H+ Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显 色.
(2)能说明第①步反应达平衡状态的是 。
a.Cr2O72—和CrO42—的浓度相同
b.2v (Cr2O72—) =v (CrO42—)
c.溶液的颜色不变
(3)第②步中,还原1mol Cr2O72—离子,需要________mol的FeSO4·7H2O。
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s) Cr3+ (aq)+3OH—(aq) 常温下,Cr(OH)3的溶度积
Cr3+ (aq)+3OH—(aq) 常温下,Cr(OH)3的溶度积
Ksp=c(Cr3+)·c3(OH—)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至 。
(每空格3分,计18分)工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为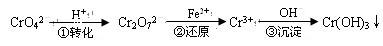
其中第①步存在平衡:2CrO42—(黄色)+2H+ Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显 色.
(2)第②步中,还原1mol Cr2O72—离子,需要________mol的FeSO4·7H2O。
(3)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s) Cr3+(aq)+3OH—(aq)
Cr3+(aq)+3OH—(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH—)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至 。
方法2:电解法
该法用Fe做电极电解含Cr2O72—的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(4)用Fe做电极的阳极反应式为:
。
(5)在阴极附近溶液pH升高的原因是(用电极反应解释) 。溶液中同时生成的沉淀还有 。
(9分)在温度T1和T2下,X2(g)和 H2反应生成HX的平衡常数如下表:
| 化学方程式 |
K (T1 ) |
K (T2) |
F2+H2  2HF 2HF |
1.8 × 1036 1036 |
1.9 ×1032 |
Cl2+H2  2HCl 2HCl |
9.7 ×1012 |
4.2 ×1011 |
Br2+H2  2HBr 2HBr |
5.6 ×107 |
9.3 ×106 |
I2+H2  2HI 2HI |
43 |
34 |
(1)仅依据K的变化,可以推断出:随着卤素原子核电荷数的增加,_______(选填字母)
a. 在相同条件下,X2的平衡转化率逐渐降低 b. X2与H2反应的剧烈程度逐渐减弱
c. HX的稳定性逐渐减弱 d. HX的还原性逐渐
(2)在容积为3L的密闭容器中,由I2(g)和H2(g)合成HI(g),在其他条件不变的情况下,研究温度对反应的影响,HI的物质的量的变化情况如下图所示。
①温度为T1时,在0~tAmin内,H2的消耗速率v (H2)=__________
②分析右图所示图像,下列说法正确的是________(填序号)
a.温度为T2,容器内气体密度不变时,反应到达B点所示状 态
态
b.平衡状态从A点移动到B点,n(HI)/n(H2)增大
c.该反应为放热反应
(3)加水稀释0.1mol·L-1的HF溶液,下列各量中增大的是________(填序号)
a.c(H+) b. Ka(HF) c. c(F-)/c(H+) d. c(H+) / c(HF)
(4)在0.1mol·L-1HCl溶液中加入过量AgNO3溶液,产生白色沉淀,再滴加KI溶液,出现黄色沉淀,试写出有关的离子方程式 、 。
已知化学反应①:Fe(s)+CO2(g) FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g) FeO(s)+H2(g),其平衡常数为K2。在温度973 K和
FeO(s)+H2(g),其平衡常数为K2。在温度973 K和
1173 K情况下,K1、K2的值分别如下:
| 温度 |
K1 |
K2 |
| 973 K |
1.47 |
2.38 |
| 1173 K |
2.15 |
1.67 |
(1)通过表格中的数值可以推断:反应①是 (填“吸热”或“放热”)反应。
(2)现有反应③:CO2(g)+H2(g) CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3= 。
CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3= 。
(3)能判断反应③已达平衡状态的是 。
A.容器中压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=c(CO)
(4)根据反应①与②可推导出K1、K2与K3之间的关系式 。据此关系式及上表数据,也能推断出反应③是 (填“吸热”或“放热”)反应。要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施是 (填写序号)。
A.缩小反应容器容积 B.扩大反应容器容积
C.降低温度 D.升高温度
E.使用合适的催化剂 F.设法减少CO的量
试题篮
()