某温度时在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:

(1)该反应的化学方程式为:
(2)反应开始至2min,用X表示的平均反应速率为:
(3)下列叙述能说明上述反应达到化学平衡状态的是 (填字母)
A.混合气体的总物质的量不随时间的变化而变化
B.单位时间内每消耗3mol X,同时生成2mol Z
C.混合气体的总质量不随时间的变化而变化
(4)在密闭容器里,通入a mol H2(g)和bmol I2,发生反应H2 (g)+ I2 (g)=2HI(g),当改变下列条件时,反应速率会发生什么变化(选填“增大”、“减小”或“不变”)
① 降低温度: ②保持容器的体积不变,增加X(g)的物质的量:
③ 增大容器的体积: ④容器容积不变,通入氖气________________。
(1)用注射器吸入少量NO2和N2O4的混合气体,发生如下反应:2NO2(g)⇌N2O4(g)当活塞迅速向里推时,气体的颜色先 ,后 (填“变深”“变浅”或“不变”前同);最终和最初相比,颜色 更深(填“最初”或“最终”下同),气体的平均相对分子质量 更大.
(2)在一定条件下,将3molA 和1mol B 两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(g).2min末该反应达到平衡,生成0.8mol D,并测得C的浓度为0.2mol•L﹣1.请填空:
xC(g)+2D(g).2min末该反应达到平衡,生成0.8mol D,并测得C的浓度为0.2mol•L﹣1.请填空:
①x= ,②B的转化率为 .
③温度降低,K值增大,则正反应是 (填“放热”或“吸热”)反应.
④能判断该反应达到平衡状态的依据是 (填编号)
A、混合气体的密度不变
B、容器中的压强不再变化
C、生成D的反应速率是生成B的反应速率的2倍
D、单位时间内生成3molA,同时生成1molB
⑤在其他条件不变的情况下,将原容器体积扩大到4L,下列有关该体系的说法正确的是( )(填编号)
A、B的浓度减少
B、正反应速率加快,逆反应速率也加快
C、C的物质的量增加
D、重新平衡时 增大.
增大.
甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列两种反应合成甲醇。
反应Ⅰ:CO(g)+2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ:CO2(g)+3H2(g) CH3OH(g)+ H2O(g) ΔH2
CH3OH(g)+ H2O(g) ΔH2
下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K):
| 温度 |
250 ℃ |
300 ℃ |
350 ℃ |
| K |
2.0 |
0.27 |
0.012 |
(1)在一定条件下将2 mol CO和6 mol H2充入2 L的密闭容器中发生反应Ⅰ,5 min后测得c(CO)="0.4" mol/L,计算可得此段时间的反应速率(用H2表示)为 mol/(L·min)。
(2)由表中数据判断ΔH1 0(填“>”、“<”或“=”);反应CO2(g)+H2(g) CO(g)+H2O(g) ΔH3= (用ΔH1和ΔH2表示)。
CO(g)+H2O(g) ΔH3= (用ΔH1和ΔH2表示)。
(3)若容器容积不变,则下列措施可提高反应Ⅰ中CO转化率的是 (填字母序号)。
A.充入CO,使体系总压强增大 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.使用高效催化剂
(4)写出反应Ⅱ的化学平衡常数表达式:KⅡ= ;保持恒温恒容,将反应Ⅱ的平衡体系中各物质浓度均增大为原来的2倍,则化学平衡 移动(填“正向”、“逆向”或“不”),平衡常数KⅡ (填“变大”、“变小”或“不变”)。
(I)在一个容积固定不变的密闭容器中进行反应:2X(g) + Y(g)  2Z(g) ,已知将2molX和1molY充入该容器中,反应在绝热条件下达到平衡时,Z的物质的量为pmol。回答下列问题:
2Z(g) ,已知将2molX和1molY充入该容器中,反应在绝热条件下达到平衡时,Z的物质的量为pmol。回答下列问题:
(1)若把2molX和1molY充入该容器时,处于状态I,达到平衡时处于状态II(如图1),则该反应的△H 0; 熵变△S___ __0 ( 填:“< ,> ,= ”)。该反应在 (填高温或低温)条件下能自发进行。

(2)该反应的v-t图像如图2中左图所示。若其他条件不变,仅在反应前加入合适的催化剂,则其v-t图像如图2中右图所示。以下说法正确的是
①a1>a2 ②b1<b2 ③t1>t2 ④右图中阴影部分面积更大⑤两图中阴影部分面积相等
(3)若该反应在容积可变的密闭容器中发生,在温度为T1、T2时,平衡体系中X的体积分数随压强变化曲线如图3所示。下列说法正确的是 。
A.A、C两点的反应速率:A>C
B.A、C两点的气体密度:A<C
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法

(II)在容积可变的密闭容器中发生反应:mA(g) + nB(g)  pC(g) ,在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
pC(g) ,在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
| 压强p/Pa |
2×105 |
5×105 |
1×106 |
| c(A)/mol·L-1 |
0.08 |
0.20 |
0.44 |
(1)当压强从2×105 Pa增加到5×105 Pa时,平衡 移动(填:向左, 向右 ,不)
(2)维持压强为2×105 Pa,当反应达到平衡状态时,体系中共有amol气体,再向体系中加入bmolB,当重新达到平衡时,体系中气体总物质的量是 mol。
(3)其他条件相同时,在上述三个压强下分别发生该反应。2×105 Pa时,A的转化率随时间变化如图4,请在图4中补充画出压强分别为5×105 Pa 和1×106 Pa时,A的转化率随时间的变化曲线(请在图4上画出曲线并标出相应压强)。
甲醇是一种可再生能源,具有广泛的开发和应用前景.请回答下列与甲醇有关的问题.
(1)甲醇分子是____________分子(填“极性”或“非极性”)。
(2)工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)  CH3OH(g)△H=﹣86.6KJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2,反应达到平衡时,容器内的压强是开始时的3/5.
CH3OH(g)△H=﹣86.6KJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2,反应达到平衡时,容器内的压强是开始时的3/5.
①达到平衡时,CO的转化率为____________
②下列选项能判断该反应达到平衡状态的依据的有____________
| A.2v(H2)=v(CH3OH) | B.CO的消耗速率等于CH3OH的生成速率 |
| C.容器内的压强保持不变 | D.混合气体的密度保持不变 |
E.混合气体的颜色保持不变 F.混合气体的平均相对分子质量不随时间而变化
(3)已知在常温常压下:
①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(g) △H=﹣akJ·mol﹣1
②2CO(g)+O2(g)=2CO2(g) △H=﹣bkl·mol﹣1
③H2O(g)=H2O(1) △H=﹣ckJ·mol﹣1
则CH3OH(1)+O2(g)=CO(g)+2H2O(1) △H=____________kJ·mol﹣1
(4)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电.
①该电池负极的电极反应式为____________________.
②若以该电池为电源,用石墨做电极电解200mL含有如下离子的溶液.
| 离子 |
Cu2+ |
H+ |
Cl﹣ |
SO42﹣ |
| c/mol·L﹣1 |
0.5 |
2 |
2 |
0.5 |
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到氧气的质量为____________.
Ⅰ、可逆反应:aA(g) + bB(g) cC(g) + dD(g);根据图回答:
cC(g) + dD(g);根据图回答:

①压强 P1 P2;(a +b) (c +d)(填“>”或“<”下同)。
②温度t1℃ t2℃;△H 0。
③保持体积和温度不变,通入He,平衡会_________________移动(填“正向”、“逆向”或“不”)。
Ⅱ、写出下列元素基态原子的电子排布式:
①29Cu____________________
②32Ge(简式)____________________
恒温、容积为1 L恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示[已知:2SO2(g) + O2(g)  2SO3(g) △H = - 196.6 kJ/mol ]。
2SO3(g) △H = - 196.6 kJ/mol ]。

请回答下列问题:
(1)写出能表示硫的燃烧热的热化学方程式:____________________。
(2)△H2 =" ____________" kJ/mol。
(3)在相同条件下,充入1 mol SO3和0.5 mol O2,则达到平衡时SO3的转化率为_________;此时该反应_______(填“放出”或“吸收”)________ kJ的能量。
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:
CO(g)+H2O(g)  CO2(g)+H2(g)反应过程中测定的部分数据见下表
CO2(g)+H2(g)反应过程中测定的部分数据见下表
| 反应时间/min |
n(CO)/mol |
n(H2O)/ mol |
| 0 |
1.20 |
0.60 |
| t1 |
0.80 |
|
| t2 |
|
0.20 |
依据题意回答下列问题:
(1)反应在t1min内的平均速率为v(H2)= mol·L-1·min-1
(2)若保持其他条件不变,起始时向容器中充入0.60molCO(g)和0.30 molH2O(g),到达平衡时,n(CO2)= mol。
(3)若保持其他条件不变,向平衡体系中再通入H2O(g) 、CO2(g)各0.10mol,达到新平衡时CO2(g)的体积分数为 。
(4)若温度升至800℃,上述反应平衡常数为0.64,则正反应为 反应(填“放热”或“吸热” )。
回答下列问题
(1)向一体积不变的密闭容器中加入2molNO2气体,发生反应2NO2(g)  N2O4(g),反应达平衡后,N2O4的体积分数为a,在温度不变的条件下,再向该容器加入1molN2O4气体,反应重新达平衡后,N2O4的体积分数为b,则a_____________b(填“>”“=”“<”,)
N2O4(g),反应达平衡后,N2O4的体积分数为a,在温度不变的条件下,再向该容器加入1molN2O4气体,反应重新达平衡后,N2O4的体积分数为b,则a_____________b(填“>”“=”“<”,)
(2)已知胆矾溶于水时溶液温度降低.胆矾分解的热化学方程式为________________
CuSO4•5H2O(s) CuSO4(s)+5H2O(l)△H=+Q1 mol•L﹣1.室温下,若将1mol无水硫酸铜溶解为溶液时放热Q2 kJ,则Q1 Q2(填写>,=或<)
CuSO4(s)+5H2O(l)△H=+Q1 mol•L﹣1.室温下,若将1mol无水硫酸铜溶解为溶液时放热Q2 kJ,则Q1 Q2(填写>,=或<)
化学理论在元素单质及其化合物反应中应用广泛.
(1)在一定条件下,可逆反应mA nB+pC△H,达到平衡状态.
nB+pC△H,达到平衡状态.
①若A、B、C都是气体,增大压强,平衡向正反应方向移动,则m n+p(填“大于”、“小于”或“等于”).
②其他条件不变,加热后A的质量减小,则反应△H 0(填“大于”、“小于”或“等于”).
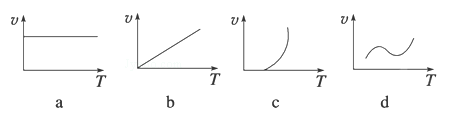
(2)某些金属氧化物(如FeXOY)粉末和Al粉在镁条的引燃下可以发生铝热反应,下列反应速率(v)和温度(T)的关系示意图中与铝热反应最接近的是 (填序号)
(3)一定温度下,发生反应:FeO(s)+CO(g) Fe(s)+CO2(g)△H.已知该反应在不同温度下的平衡常数如下表:
Fe(s)+CO2(g)△H.已知该反应在不同温度下的平衡常数如下表:
| 温度/℃ |
1000 |
1100 |
| 平衡常数 |
0.68 |
0.50 |
请回答下列问题:
①该反应的△H 0(填“>”、“<”或“=”).
②T℃时,将FeO(s)和CO(g)各3.0mol加入10L的密闭容器中,反应达到平衡后,测得CO转化率为W1,c(CO2)=0.15mol•L﹣1,则温度T (填“高于”、“低于”、“等于”)1000,若此时保持其它条件不变再充入2.0mol CO(g),再达平衡时测得CO转化率为W2,则W1 W2(填“>”、“<”或“=”) .
二甲醚(CH3OCH3)和甲醇(CH3OH)被称为21世纪的新型燃料.以CH4和H2O为原料制备二甲醚和甲醇的工业流程如下:

请填空:
(1)一定条件下,反应室1中发生反应CH4(g)+H2O(g)═CO(g)+3H2(g)△H>0.其它条件不变,只降低温度,逆反应速率将 (填“增大”、“减小”或“不变”).
(2)图1中反应室3(容积可变的密闭容器)中0.2mol CO与0.4mol H2在催化剂作用下发生可逆反应生成甲醇:CO(g)+2H2(g) CH3OH(g),CO的平衡转化率与温度、压强的关系如图2所示,则:
CH3OH(g),CO的平衡转化率与温度、压强的关系如图2所示,则:

①P1 P2(填“<”、“>”或“=”).
②在压强P1下,100℃时反应达到化学平衡,反应室3的容积变为2L,此时CO平衡常为 , 若温度不变,再加入1.0mol CO后重新达到平衡,CO的平衡转化率 (填“增大”、“不变”或“减小”).
③保持容积为2L不变,温度100℃不变,向反应室3中再通入0.2mol CO与0.4mol H2,CO的平衡转化率 (填“增大”、“不变”或“减小”).
降低大气中CO2的含量及有效地开发利用 CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在一定体积的恒容密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.
CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.

(1)从反应开始到平衡,氢气的平均反应速率v(H2)= mol/(L•min);
(2)氢气的转化率= ;
(3)下列措施中能使平衡体系中 减少的是 .
减少的是 .
A.将H2O(g)从体系中分离出去
B.充入He(g),使体系压强增大
C.升高温度
D.再充入1molH2
(4)下列不能表示反应达到平衡状态的是
A.体系压强不再改变
B.混合气体的密度不再改变
C.容器内的温度不再改变
D.混合气体的平均分子质量不再改变
E.V(CO2):V(H2O)=1:1
F.混合气体的总物质的量不再改变
(1)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:
2IO3﹣+5SO32﹣+2H+═I2+5SO42﹣+H2O,生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率,某同学设计实验如表所示:
| |
0.01mol•L﹣1 KIO3酸性溶液(含淀粉)的体积/mL |
0.01mol•L﹣1 Na2SO3溶液的体积/mL |
H2O的体积 /mL |
实验 温度 /℃ |
溶液出现蓝色时所需时间/s |
| 实验1 |
5 |
V1 |
35 |
25 |
|
| 实验2 |
5 |
5 |
40 |
25 |
|
| 实验3 |
5 |
5 |
V2 |
0 |
|
该实验的目的是 ,表中V1= mL.
(2)可逆反应C(s)+H2O(g) H2(g)+CO(g),△H>0达到平衡后,改变某一外界条件(不改变物质的量的条件下),反应速率v与时间t的关系如图.
H2(g)+CO(g),△H>0达到平衡后,改变某一外界条件(不改变物质的量的条件下),反应速率v与时间t的关系如图.
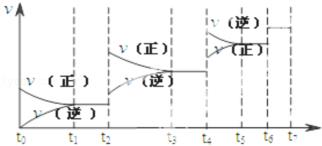
①图中t2到t3段、t4到t6段时引起平衡移动的条件分别可能是 、 ;
②图中表示平衡混合物中CO的含量最高的一段时间是 .
高炉炼铁过程中发生的主要反应为:1/3Fe2O3(s)+CO(g) 2/3Fe(s)+CO2(g)
2/3Fe(s)+CO2(g)
已知该反应在不同温度下的平衡常数如下:
| 温度/℃ |
1000 |
1150 |
1300 |
| 平衡常数 |
4.0 |
3.7 |
3.5 |
(1)该反应的平衡常数表达式K=________ ,ΔH________0(填“>”、“<”或“=”);
(2)在一个容积为5L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,此时比较v(正) v(逆) (填“>” “="”" “<”),反应经过2min后达到平衡。求该时间范围内反应的平均反应速率v(CO2)=________ ,CO的平衡转化率=________ ;
(3)欲提高(2)中CO的平衡转化率,可采取的措施是________。
A、减少Fe的量 B、增加Fe2O3的量 C、移出部分CO2
D、提高反应温度 E、减小容器的容积 F、加入合适的催化剂
试题篮
()