Ⅰ.某实验小组对H2O2的分解做了如下探究。下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15 ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
| MnO2 |
触摸试管情况 |
观察结果 |
反应完成所需的时间 |
| 粉末状 |
很烫 |
剧烈反应,带火星的木条复燃 |
3.5min |
| 块状 |
微热 |
反应较慢,火星红亮但木条未复燃 |
30min |
(1)写出上述实验中发生反应的化学方程式: 。
(2)实验结果表明,催化剂的催化效果与 有关。
(3)某同学在10 mL H2O2溶液中加入一定量的二氧化锰,放出气体的体积(标准状况)与反应时间的关系如图所示,则A、B、C三点所表示的即时反应速率最慢的是 。

Ⅱ.某反应在体积为5L的恒容密闭容器中进行, 在0-3分钟内各物质的量的变化情况如右下图所示(A,B,C均为气体,且A气体有颜色)。

(4)该反应的的化学方程式为 。
(5)反应开始至2分钟时,B的平均反应速率为 。
(6)能说明该反应已达到平衡状态的是
a.v(A)= 2v(B) b.容器内各物质的物质的量相等
c.v逆(A)=v正(C) d.容器内气体的颜色保持不变
(7)由图求得平衡时A的转化率为 。
(12分)甲醇是重要的化学工业基础原料和清洁液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知制备甲醇的有关化学反应以及在不同温度下的化学平衡常数如下表所示:

(1)反应②是 (填“吸热”或“放热”)反应。
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(p)的关系如图甲所示。则平衡状态由A变到B时,平衡常数K(A) K(B)(填“>”“<”或“=”)。
(3)据反应①与②可推导出K1、K2与K3之间的关系,则K3= (用K1、K2表示)。500 ℃时测得反应③在某时刻时,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol·L-1)分别为0.8、0.1、0.3、0.15,则此时v正 v逆 (填“ > ”“=”或“<”)。
(4)在3 L容积可变的密闭容器中发生反应②,已知c(CO) -t(反应时间)变化曲线Ⅰ如图乙所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ
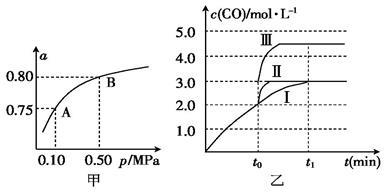
当曲线Ⅰ变为曲线Ⅱ时,改变的条件是 ;当曲线Ⅰ变为曲线Ⅲ时,改变的条是 。
天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷。
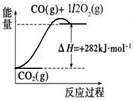
(1)已知:CH4(g)+2O2(g)===CO2(g)+2H2O(g) ∆H1
CO(g)+H2O(g)===CO2(g)+H2(g) ∆H2
2CO(g)+O2(g)===2CO2(g) ∆H3
则CO2(g)+CH4(g)===2CO(g)+2H2(g)的∆H= 。
(2)天然气中的少量H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式 。
(3)天然气的一个重要用途是制取H2,其原理为:
CO2(g)+CH4(g)  2CO(g)+2H2(g)。
2CO(g)+2H2(g)。
①该反应的平衡常数表达式为 。
②在密闭容器中通入物质的量浓度均为0.1 mol•L—1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如图l所示。则压强P1 P2 (填“大于”或“小于”);压强为P2时,在Y点:v(正) v (逆)(填“大于"、“小于”或“等于")。
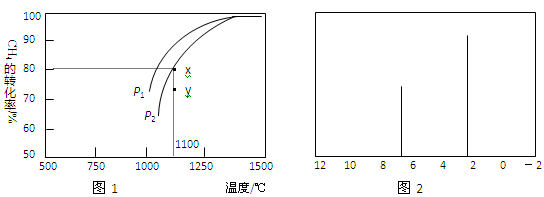
(4)天然气也可重整生产化工原料,最近科学家们利用天然气无氧催化重整获得芳香烃X。由质谱分析得X的相对分子质量为l06,其核磁共振氢谱如图2所示,则X的结构简式为 。
(5)科学家用氮化镓材料与铜组装如右图所示人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4。
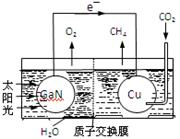
①写出铜电极表面的电极反应式 。
②为提高该人工光合系统的工作效率,可向装置中加入少量 (选填“盐酸”或“硫酸”)。
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),
CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
(1)该反应的化学平衡常数表达式为K = 。
(2)该反应为 反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是 (多选扣分)。
A.容器中压强不变 B.混合气体中c(CO)不变
C.υ正(H2)=υ逆(H2O) D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。
目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2+3H2  CH3OH+H2O,该反应的能量变化如图所示:
CH3OH+H2O,该反应的能量变化如图所示:
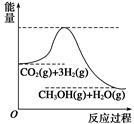
(1)甲同学认为该反应为放热反应,他的理由为: 。
(2)在体积为2 L的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2的物质的量随时间变化如下表所示。从反应开始到5min末,用CO2浓度变化表示的平均反应速率v(CO2)= ;反应达到平衡状态,此时H2的转化率为 。
| t/min |
0 |
2 |
5 |
10 |
15 |
| n(CO2)/mol |
1 |
0.75 |
0.5 |
0.25 |
0.25 |
(3)在相同温度、容积不变的条件下,能说明该反应已达平衡状态的是 (填序号)。
a.v生成(CH3OH)=v消耗(CO2)
b.CO2、H2、CH3OH、H2O的浓度均不再变化
c.n(CO2)∶n(H2)∶n(CH3OH)∶n(H2O)=1∶1∶1∶1
d.H2的消耗速率与CH3OH的消耗速率之比为3∶1
目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2+3H2  CH3OH+H2O,该反应的能量变化如图所示:
CH3OH+H2O,该反应的能量变化如图所示:
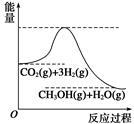
(1)甲同学认为该反应为放热反应,他的理由为: 。
(2)在体积为2 L的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2的物质的量随时间变化如下表所示。从反应开始到5min末,用CO2浓度变化表示的平均反应速率v(CO2)= ;反应达到平衡状态,此时H2的转化率为 。
| t/min |
0 |
2 |
5 |
10 |
15 |
| n(CO2)/mol |
1 |
0.75 |
0.5 |
0.25 |
0.25 |
(3)在相同温度、容积不变的条件下,能说明该反应已达平衡状态的是 (填序号)。
a.v生成(CH3OH)=v消耗(CO2)
b.CO2、H2、CH3OH、H2O的浓度均不再变化
c.n(CO2)∶n(H2)∶n(CH3OH)∶n(H2O)=1∶1∶1∶1
d.H2的消耗速率与CH3OH的消耗速率之比为3∶1
湿法炼锌的冶炼过程可用如图简略表示:
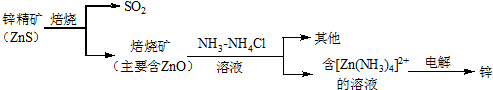
请回答下列问题:
(1)NH3的空间构型是 .氨气易液化,液氨常做制冷剂,氨气易液化的原因是 .
(2)已知ZnO属于两性氧化物,写出ZnO与NaOH溶液反应的化学方程式: .
(3)上述电解过程中析出锌的电极反应式为 .
(4)产生的SO2可用Ba(NO3)2溶液吸收,部分产物可作为工业原料,其反应的离子方程式为 .
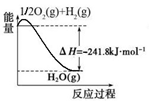
(5)氨是最重要的化工产品之一。合成氨用的氢气可以甲烷为原料制得:CH4(g)+H2O(g) CO(g)+3H2(g)。有关化学反应的能量变化如下图所示,则CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为 .
CO(g)+3H2(g)。有关化学反应的能量变化如下图所示,则CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为 .

(6)CO对合成氨的催化剂有毒害作用,常用乙酸二氨合铜(Ⅰ)溶液来吸收原料气中CO,其反应原理为:[Cu(NH3)2CH3COO](l)+CO(g)+NH3(g) [Cu(NH3)3]CH3COO·CO(l) △H<0。吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是 ________(填写选项编号).
[Cu(NH3)3]CH3COO·CO(l) △H<0。吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是 ________(填写选项编号).
A.高温、高压 B.高温、低压
C.低温、低压 D.低温、高压
(7)用氨气制取尿素[CO(NH2)2]的反应为:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g) △H<0,恒温恒容密闭容器中,下列依据能说明该反应达到平衡状态的是 .
CO(NH2)2(l)+H2O(g) △H<0,恒温恒容密闭容器中,下列依据能说明该反应达到平衡状态的是 .
A、容器中气体密度不变
B、容器中气体压强不变
C、n(NH3):n(CO2)=1:2
D、单位时间内消耗1molCO2,同时消耗1molH2O
E、容器内温度保持不变
(8)某温度下,向容积为100L的密闭容器中通入4mol NH3和2molCO2,发生2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g)反应,该反应进行到40 s时达到平衡,此时CO2的转化率为50%。该温度下此反应平衡常数K的值为________.上图中的曲线表示该反应在前25 s内的反应进程中的NH3浓度变化。若反应延续至70s,保持其它条件不变情况下,请在图中用实线画出使用催化剂时该反应从开始至平衡时的曲线。
CO(NH2)2(l)+H2O(g)反应,该反应进行到40 s时达到平衡,此时CO2的转化率为50%。该温度下此反应平衡常数K的值为________.上图中的曲线表示该反应在前25 s内的反应进程中的NH3浓度变化。若反应延续至70s,保持其它条件不变情况下,请在图中用实线画出使用催化剂时该反应从开始至平衡时的曲线。

在一定温度下,把2体积N2和6体积H2通入一个带活塞的体积可变的容器中,活塞的一端与大气相通如图所示。容器中发生以下反应:N2+3H2 2NH3(正反应为放热反应)。若反应达平衡后,测得混合气体的体积为7体积,据此回答下列问题:
2NH3(正反应为放热反应)。若反应达平衡后,测得混合气体的体积为7体积,据此回答下列问题:

(1)保持上述反应温度不变,设a、b、c分别代表初始加入的N2、H2和NH3的体积,如果反应达到平衡后混合气体中各物质的体积仍与上述平衡时完全相同,那么:
①若a=1,c=2,则b=____。在此情况下,反应起始时将向______(填“正”或“逆”)反应方向进行。
②若需规定起始时反应向逆反应方向进行,则c的范围是______。
(2)在上述装置中,若需控制平衡后混合气体为6.5体积,则可采取的措施是______,原因是 。
如图所示,向A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,起始时,V(A)=V(B)=a L。在相同温度和有催化剂存在的条件下,两容器中各自发生下述反应:X+Y 2Z+W △H<0(X、Y、Z、W均为气体),达到平衡时,V(A)=1.2aL,试回答:
2Z+W △H<0(X、Y、Z、W均为气体),达到平衡时,V(A)=1.2aL,试回答:
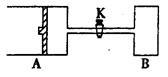
(1)A中X的转化率α(A)=________;
(2)A、B中X转化率的关系:α(A)_________ α(B)(填“>”、“=”“<”);
(3)打开K,一段时间又达到平衡时,A的体积为_______L(连通管中气体体积不计)
在一定条件下,将2molA和2molB混合于容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)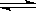 xC(g)+2D(g)。2min末反应达到平衡状态时,生成0.8molD,同时测得C的浓度为0.4mol/L。请填写下列空白:
xC(g)+2D(g)。2min末反应达到平衡状态时,生成0.8molD,同时测得C的浓度为0.4mol/L。请填写下列空白:
(1)x=______;用D的浓度变化表示的化学反应速率为_____________。
(2)A的平衡浓度为_______,B的转化率为__________。
(3)如果增大体系的压强,则平衡体系中C的体积分数将____(填“增大”“减小”或“不变”)。
(4)如果上述反应在相同条件下从逆反应开始进行,起始时加入C和D各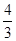 mol,要使平衡时各物质的体积分数与原平衡时完全相同,则还应加入______物质________mol
mol,要使平衡时各物质的体积分数与原平衡时完全相同,则还应加入______物质________mol
由等物质的量的X气体和Y气体组成的混合气体,在一定条件下进行如下图所示的反应:X(g)+Y(g)  nZ(g) 经时间t后,产物Z气体在反应混合物中的物质的量百分数与温度的关系如图所示,经分析可知:
nZ(g) 经时间t后,产物Z气体在反应混合物中的物质的量百分数与温度的关系如图所示,经分析可知:
(1)该化学反应的正反应方向是_______热反应。
(2)T1表示该反应在时间t内可达平衡的______(填“最高”或“最低”)温度。
(3)在T<T1的某一温度内,该反应_________(填“能”或“不能”)建立平衡。
(4)在温度T2时增大压强,达新平衡时ω(Z)将增大,则系数n的值是_______,向_____移动。
减少污染、保护环境是全世界最热门的课题。
(1)为了减少空气中SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+1/2O2(g)==H2O(g) ΔH1=-241.8 kJ·mol-1
C(s)+1/2O2(g)===CO(g) ΔH2=-110.5 kJ·mol-1
则焦炭与水蒸气反应生成CO的热化学方程式为 。
②洗涤含SO2的烟气。以下物质可作洗涤剂的是 (填序号):
a.Ca(OH)2 b.CaCl2 c.Na2CO3 d.NaHSO3
(2)CO在催化剂作用下可以与H2反应生成甲醇:CO(g)+2H2(g)  CH3OH(g)。
CH3OH(g)。
在密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如图所示。

①M、N两点平衡状态下,容器中总物质的物质的
量之比为:n(M)总:n(N)总= 。
②若M、N、Q三点的平衡常数KM、KN、KQ的
大小关系为 。
(3)催化硝化法和电化学降解法可用于治理水中硝酸盐的污染。
①催化硝化法中,用H2将NO3-还原为N2,一段时间后,溶液的碱性明显增强。则该反应离子方程式为 。
②电化学降解NO3-的原理如图所示,电源正极为 (填“a”或“b”);若总反应为4NO3-+4H+====5O2↑+2N2↑+2H2O,则阴极反应式为 。

氢气是一种清洁能。用甲烷制取氢气的两步反应的能量变化如下图所示:

(1)甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是 。
(2)第II步为可逆反应。在800℃时,若CO的起始浓度为2.0 mol/L,水蒸气的起始浓度为3.0 mol/L,达到化学平衡状态后,测得CO2的浓度为1.2 mol/L,则此反应的平衡常数为 ,随着温度升高该反应的化学平衡常数的变化趋势是 。
(3)在恒温恒容密闭容器中进行的第II步反应,下列说法中能表示达到平衡状态的是______(填序号)。
a. 四种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比
b. 单位时间内断开amol H-H键的同时断开2a mol O-H键
c. 反应容器中放出的热量不再变化
d. 混合气体的密度不再发生变化
e. 混合气体的压强不再发生变化
(4)某温度下,第II步反应的平衡常数为K=1/9。该温度下在甲、乙、丙三个恒容密闭容器中投入H2O(g)和CO(g),其起始浓度如下表所示。下列判断不正确的是 。
| 起始浓度 |
甲 |
乙 |
丙 |
| c(H2O)/ mol/L |
0.010 |
0.020 |
0.020 |
| c(CO)/ mol/L |
0.010 |
0.010 |
0.020 |
A. 反应开始时,丙中的反应速率最快,甲中的反应速率最慢
B. 平衡时,甲中和丙中H2O的转化率均是25%
C. 平衡时,丙中c(CO2)是甲中的2倍,是0.015mol/L
D. 平衡时,乙中H2O的转化率大于25%
氢气是一种清洁能源。用甲烷制取氢气的两步反应的能量变化如下
图所示:
(1)甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是_________________。
(2)第II步为可逆反应。在800℃时,若CO的起始浓度为2.0 mol/L,水蒸气的起始浓度为3.0 mol/L,达到化学平衡状态后,测得CO2的浓度为1.2 mol/L,则此反应的平衡常数为___________,CO的平衡转化率为____________。
高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g)  2Fe(s)+3CO2(g) ΔH =" a" kJ mol-1
2Fe(s)+3CO2(g) ΔH =" a" kJ mol-1
(1)已知: ①Fe2O3(s)+3C(石墨) = 2Fe(s)+3CO(g) ΔH1 =" +" 489.0 kJ mol-1
②C(石墨)+CO2(g) = 2CO(g) ΔH2 =" +" 172.5 kJ mol-1
则a = kJ mol-1。
(2)冶炼铁反应的平衡常数表达式K = ,温度升高后,K值 (填“增大”、“不变”或“减小”)。
(3)在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
| |
Fe2O3 |
CO |
Fe |
CO2 |
| 甲/mol |
1.0 |
1.0 |
1.0 |
1.0 |
| 乙/mol |
1.0 |
2.0 |
1.0 |
1.0 |
①甲容器中CO的平衡转化率为 。
②下列说法正确的是 (填字母)。
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.甲容器中CO的平衡转化率大于乙的
c.甲、乙容器中,CO的平衡浓度之比为2∶3
d.增加Fe2O3可以提高CO的转化率
(4)采取一定措施可防止钢铁腐蚀。下列装置中的烧杯里均盛有等浓度、等体积的NaCl溶液。

①在a~c装置中,能保护铁的是 (填字母)。
②若用d装置保护铁,X极的电极材料应是 (填名称)。
试题篮
()