已知T℃、P kPa时,在容积为V L密闭容器内充有1 mol A和1 mol B.保持恒温恒压,使反应:A(g)+B(g) C(g) 达到平衡时,C的体积分数为40%。试回答有关问题:
C(g) 达到平衡时,C的体积分数为40%。试回答有关问题:
(1)欲使温度和压强在上述条件下恒定不变,在密闭容器内充入2 mol C,则反应达到平衡时,容器的容积为___________,C的体积分数为_________。
(2)若另选一容积固定不变的密闭容器,仍控制温度为T℃,使1 mol A和1 mol B反应达到平衡状态时,C的体积分数仍为40%,则该密闭容器的容积为_________。
某温度时在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:
(1)该反应的化学方程式为: 。
(2)反应开始至2min,用Z表示的平均反应速率为: 。
(3)下列叙述能说明上述反应达到化学平衡状态的是 (填序号)
| A.混合气体的总物质的量不随时间的变化而变化 |
| B.混合气体的压强不随时间的变化而变化 |
| C.单位时间内每消耗3mol X,同时生成2 mol Z |
| D.混合气体的总质量不随时间的变化而变化 |
E.恒定容积,混合气体的密度不再发生改变
(4)在密闭容器里,通入a mol X(g)和b mol Y(g),发生反应X(g)+ Y(g) 2Z(g),当改变下列条件时,反应速率会发生什么变化?(选填“增大”、“减小”或“不变”)
2Z(g),当改变下列条件时,反应速率会发生什么变化?(选填“增大”、“减小”或“不变”)
①升高温度,反应速率 ;
②保持容器体积不变,充入不参加反应的惰性气体,反应速率 。
Ⅰ.1100℃时,体积为2L的恒容容器中发生如下反应:Na2SO4(s)+4H2(g) Na2S(s)+4H2O(g)
Na2S(s)+4H2O(g)
(1)下列能判断反应达到平衡状态的是________。
| A.容器内气体压强不再变化 |
| B.H2的体积分数不再变化 |
| C.1 mol H-H键断裂同时2 mol H-O键形成 |
| D.Na2S的质量不再变化 |
E.υ(正)=υ(逆)
F.容器内气体密度不再变化
(2)若2 min时反应达平衡,此时气体质量增加8 g,则用H2表示该反应的反应速率为: 。
Ⅱ.丙烷燃料电池,以KOH溶液为电解质溶液。
(3)通入丙烷的电极为_____(填“正极”或“负极”),正极的电极反应式为 。
(4)燃料电池的优点________。
(5)若开始时电解质溶液中含KOH的物质的量为0.25 mol,当溶液中K2CO3的物质的量为0.1 mol时,消耗标准状况下丙烷的体积为 mL(保留一位小数)。
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:2H2(g) + CO(g)  CH3OH(g)
CH3OH(g)
(1)判断反应达到平衡状态的依据是 (填序号)。
a. 生成CH3OH的速率与消耗CO的速率相等
b. 混合气体的密度不变
c. 混合气体的平均相对分子质量不变
d. CH3OH、CO、H2的浓度都不再发生变化
(2)下表所列数据是该反应在不同温度下的化学平衡常数(K)
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
①该反应的平衡常数表达式K= ,△H 0(填“>”、“<”或“=”)。
②要提高CO的转化率,可以采取的措施是_____________(填序号)。
a.升温
b.加入催化剂
c.增加CO的浓度
d.加入H2加压
e.加入惰性气体加压
f.分离出甲醇
③300℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是 (填字母)。
A.c(H2)减少 B.正反应速率加快,逆反应速率减慢
C.CH3OH 的物质的量增加 D.重新平衡时c(H2)/ c(CH3OH)减小
④某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)= 0.2 mol/L,则CO的转化率为 ,此时的温度为 。以CH3OH表示该过程的反应速率v(CH3OH)= mol /(L · min)。
(3)下图表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A____C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A_____C,由状态B到状态A,可采用______的方法(填“升温”或“降温”)。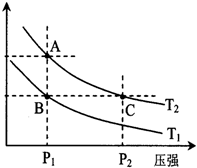
(4)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH =-a kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH =-b kJ·mol-1
③H2O(g)= H2O(l) ΔH=-c kJ·mol-1
则,CH3OH(l)+O2(g) =CO(g)+2H2O(l) ΔH= kJ·mol-1。
Ⅰ.在一定条件下,xA+yB  zC,达到平衡,试填写下列空白:
zC,达到平衡,试填写下列空白:
(1)已知C是气体,且x+y=z,加压时平衡如果发生移动,则平衡必向___ ___移动。
(2)若B、C是气体,其他条件不变时增加A的用量,平衡不移动,则A的状态为___ ___。
Ⅱ.已知NO2和N2O4可以相互转化:2NO2(g)  N2O4(g) ΔH<0。现将一定量NO2和N2O4的混合气体通入一体积为2 L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图。
N2O4(g) ΔH<0。现将一定量NO2和N2O4的混合气体通入一体积为2 L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图。
(1)图中共有两条曲线X和Y,其中曲线_______表示NO2浓度随时间的变化;a、b、c、d四个点中,
表示化学反应处于平衡状态的点是__________。
(2)①前10 min内用NO2表示的化学反应速率v(NO2)=_______mol·L-1·min-1。
②0~15 min ,反应2NO2(g)  N2O4(g)的平衡常数Kb=_______。
N2O4(g)的平衡常数Kb=_______。
③25 min~35 min时,反应2NO2(g)  N2O4(g)的平衡常数Kd_____Kb(填“>”、“=”或“<”)。
N2O4(g)的平衡常数Kd_____Kb(填“>”、“=”或“<”)。
(3)反应25 min时,若只改变了某一个条件,使曲线发生如上图所示的变化,该条件可能是_________(用文字表达),若要达到使NO2(g)的百分含量与d点相同的化学平衡状态,在25 min时还可以采取的措施是_________。
A.加入催化剂 B.缩小容器体积
C.升高温度 D.加入一定量的N2O4
近年来北京市汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物。
(1)汽车内燃机工作时引起反应:N2(g)+O2(g) 2NO(g),是导致汽车尾气中含有NO的原因之一。T℃时,向容积为2 L的密闭容器中充入10molN2与5molO2,达到平衡后NO的物质的量为2mol,则T℃时该反应的平衡常数K= 。(计算结果保留小数点后两位数字)
2NO(g),是导致汽车尾气中含有NO的原因之一。T℃时,向容积为2 L的密闭容器中充入10molN2与5molO2,达到平衡后NO的物质的量为2mol,则T℃时该反应的平衡常数K= 。(计算结果保留小数点后两位数字)
(2)一定量的NO发生分解的过程中,NO的转化率随时间变化的曲线如图所示。(已知: )
)
①反应2NO(g) N2(g)+O2(g)为(填“吸热”或“放热) 反应。
N2(g)+O2(g)为(填“吸热”或“放热) 反应。
②一定温度下,能够说明反应 2NO(g) N2(g)+O2(g)已达到平衡的是(填序号) 。
N2(g)+O2(g)已达到平衡的是(填序号) 。
a.容器内的压强不发生变化
b.NO、N2、O2的浓度保持不变
c.NO分解的速率和NO生成的速率相等
d.单位时间内分解4mol NO,同时生成2 mol N2
(3)①当发动机采用稀薄燃烧时,尾气中的主要污染物为NOx,可用 CxHy(烃)催化还原NO2消除氮氧化物的污染。
已知:CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)=CO2(g)+2H2O(g) △H2
CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g) △H3=-867kJ·mol-1,
△H2= .
②使用催化剂可以将汽车尾气的主要有害成分一氧化碳(CO)和氮氧化物(NOx)转化为无毒气体,该反应的化学方程式为 。
合成氨工业的核心反应是:N2(g)+3H2(g)  2NH3(g) ΔH="Q" kJ·mol-1,能量变化如图所示,回答下列问题:
2NH3(g) ΔH="Q" kJ·mol-1,能量变化如图所示,回答下列问题:
(1)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1_________(填“增大”、“减小”、“不变”)
(2)在500 ℃、2×107 Pa和催化剂条件下向一密闭容器中充入0.5 mol N2和1.5 mol H2,充分反应后,放出的热量_________ 46.2 kJ(填“<”、“>”或“=”)
(3)关于该反应的下列说法中,正确的是_________。
A.ΔH>0,气体分子数目增多 B.ΔH>0,气体分子数目减少
C.ΔH<0,气体分子数目增多 D.ΔH<0,气体分子数目减少
(4)将一定量的N2(g)和H2(g)放入1 L密闭容器中,在500 ℃、2×107 Pa下达到平衡,测得N2为0.10 mol,H2为0.30 mol,NH3为0.10 mol。计算该条件下达到平衡时H2转化为NH3的转化率_________。若升高温度,K值变化_______(填“增大”、“减小”或“不变”)。
(5)在上述(4)反应条件的密闭容器中欲提高合成氨中H2的转化率,下列措施可行的__(填字母)。
A.向容器中按原比例再充入原料气 B.向容器中再充入惰性气体
C.改变反应的催化剂 D.分离出氨气
(14分)工业制硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键的步骤。
(1)一定条件下,SO2可发生反应:SO2(g)+ O2(g)
O2(g) SO3(g) △H=﹣98kJ·mol﹣1。
SO3(g) △H=﹣98kJ·mol﹣1。
①某温度下,在100 L的恒容密闭容器中开始加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出热量196 kJ,该温度下平衡常数K=_______(用分数表示)。
②上述反应按照相同的物质的量投料,测得SO2在不同温度下的平衡转化率a%与压强的关系如下图所示。下列说法正确的是_______(填序号)。
| A.温度:T3>T2>T1 |
| B.正反应速率:v(c)>v(a),v(b)>v(d) |
| C.平衡常数:K(a)>k(c),K(b)=K(d) |
| D.平均摩尔质量:M(a)>M(c),M(b)>M(d) |
③上述反应达平衡后,保持温度和容器的压强不变,若再通入一定量SO3(g),则SO2的体积分数_______(填“增大”、“减小”、“不变”)。
(2)某人设想以下图所示装置用电化学原理模拟生产硫酸: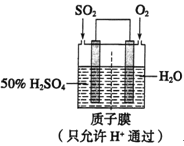
①通入O2的电极是________极。
②写出通入SO2的电极的电极反应式:_______________
③若此过程中转移了0.2mol电子,则质子膜两侧电解液的质量变化差(△m左﹣△m右)为________g(忽略气体的溶解)。
(12分)
(1)在一体积为10L的容器中,通入一定量的CO和H2O。在850℃时发生如下反应:CO(g)+H2O(g) CO2(g)+H2(g) △H<0 CO和H2O浓度变化如图,
CO2(g)+H2(g) △H<0 CO和H2O浓度变化如图,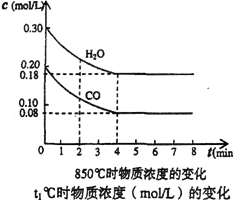
则0~4min的平均反应速率v(CO)= ______,达到平衡时,H2O(g)的转化率为_________。
(2)t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如右表。
①表中3min~4min之间反应处于________状态; C1数值________0.08mol/L(填>,<,=)。
②反应在4min~5min间,平衡向逆方向移动,可能的原因是_________(单选),表中5min~6min之间数值发生变化,可能的原因是_________(单选)。
| A.加水蒸气 | B.降低温度 | C.使用催化剂 | D.增加氢气浓度 |
减少污染、保护环境是全世界最热门的课题。
(1)为了减少空气中SO2的排放,常采取的措施有:
将煤转化为清洁气体燃料。
已知:H2(g)+1/2O2(g)==H2O(g) ΔH1=-241.8 kJ·mol-1
C(s)+1/2O2(g)===CO(g) ΔH2=-110.5 kJ·mol-1
则焦炭与水蒸气反应生成CO的热化学方程式为:_________________________。
(2)CO在催化剂作用下可以与H2反应生成甲醇:CO(g)+2H2(g) 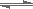 CH3OH(g)。在密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如图所示。
CH3OH(g)。在密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如图所示。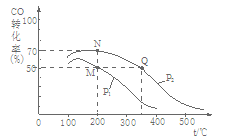
①M、N两点平衡状态下,容器中总物质的物质的量之比为:n(M)总:n(N)总= 。
②若M、N、Q三点的平衡常数KM、KN、KQ的大小关系为 。
(3)电化学降解NO—的原理如图所示,电源正极为 (填“a”或“b”);若总反应为4NO3-+4H+ 5O2↑+2N2↑+2H2O,则阴极反应式为_________________。
5O2↑+2N2↑+2H2O,则阴极反应式为_________________。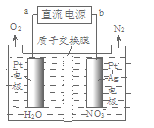
(4)已知25 ℃时,电离常数Ka(HF)=3.6×10-4,溶度积常数Ksp(CaF2)=1.5×10-10。现向1000 L 1.5×10-2mol/L CaCl2溶液中通入氟化氢气体,当开始出现白色沉淀时,通入的氟化氢为____________ mol(保留3位有效数字)。
(1)某温度时,在3 L密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示,由图中数据分析:
①该反应的化学方程式为:____________________。
②反应开始至2 min末,X的反应速率为________。
③该反应是由________________开始反应的(填“正反应”、“逆反应”或“正、逆反应同时”)。
(2)对于上述反应NH2CO2NH4(s) CO(NH2)2(s)+H2O(g) △H=+116.5 kJ·mol-1在密闭容器中将过量NH2CO2NH4固体于400K下分解,平衡时体系压强为a Pa,若反应温度不变,将体系的体积增加50%,则体系的压强是 Pa(用含a的式子表示)。
CO(NH2)2(s)+H2O(g) △H=+116.5 kJ·mol-1在密闭容器中将过量NH2CO2NH4固体于400K下分解,平衡时体系压强为a Pa,若反应温度不变,将体系的体积增加50%,则体系的压强是 Pa(用含a的式子表示)。
如图所示,向A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,起始时,V(A)=V(B)=a L。在相同温度和有催化剂存在的条件下,两容器中各自发生下述反应:
X+Y 2Z+W △H<0(X、Y、Z、W均为气体),
2Z+W △H<0(X、Y、Z、W均为气体),
达到平衡时,V(A)=1.2aL,试回答:
(1)A中X的转化率α(A)=________;
(2)A、B中X转化率的关系:α(A)_________ α(B)(填“>”、“=”“<”);
(3)打开K,一段时间又达到平衡时,A的体积为_______L(连通管中气体体积不计)
反应aA(g)+bB(g) cC(g)+dD(g)在容积不变的密闭容器中达平衡,且起始时A和B的物质的量之比为a:b,则:
cC(g)+dD(g)在容积不变的密闭容器中达平衡,且起始时A和B的物质的量之比为a:b,则:
(1)平衡时,A、B转化率之比是_________。
(2)若同等倍数地增大A、B的物质的量浓度,使A与B转化率同时增大,(a+b)与(c+d)所满足的关系是___________。
(3)若a="2" b="1" c="3" d=2在甲、乙、丙、丁4个容器中A的物质的量依次是2mol、1mol、2mol、1mol,B物质的量依次是1mol、1mol、2mol、2mol,C、D物质的量均为0,则在同条件下达平衡时B的转化率由大→小顺序_________,A的转化率由大→小顺序__________。
在一定条件下,将2molA和2molB混合于容积为2L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(g)。2min末反应达到平衡状态时,生成0.8molD,同时测得C的浓度为0.4mol/L。请填写下列空白:
xC(g)+2D(g)。2min末反应达到平衡状态时,生成0.8molD,同时测得C的浓度为0.4mol/L。请填写下列空白:
(1)x=______;用D的浓度变化表示的化学反应速率为_____________。
(2)A的平衡浓度为_______,B的转化率为__________。
(3)如果增大体系的压强,则平衡体系中C的体积分数将____(填“增大”“减小”或“不变”)。
(4)如果上述反应在相同条件下从逆反应开始进行,起始时加入C和D各 mol,要使平衡时各物质的体积分数与原平衡时完全相同,则还应加入______物质________mol。
mol,要使平衡时各物质的体积分数与原平衡时完全相同,则还应加入______物质________mol。
试题篮
()