Ⅰ已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g) △H=_1275.6kJ•mol-1
②H2O(l)═H2O(g) △H=+44.0kJ•mol-1
写出表示甲醇燃烧热的热化学方程式: 。
Ⅱ.甲醇可以与水蒸气反应生成氢气,反应方程式如下:
CH3OH(g) + H2O(g)  CO2(g) + 3H2(g) ;△H>0
CO2(g) + 3H2(g) ;△H>0
(1)一定条件下,向体积为2L的恒容密闭容器中充入1molCH3OH(g)和3molH2O(g),20s后,测得混合气体的压强是反应前的1.2倍,则用甲醇表示该反应的速率为 。
(2)判断⑴中可逆反应达到平衡状态的依据是(填序号) 。
①v正(CH3OH) = 3v逆(H2) ②混合气体的密度不变 ③混合气体的平均相对分子质量不变 ④CH3OH、H2O、CO2、H2的浓度都不再发生变化
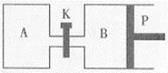
(3)右图中P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1molCH3OH(g)和2molH2O(g),向B容器中充入1.2molCH3OH(g) 和2.4molH2O(g),两容器分别发生上述反应。已知起始时容器A和B的体积均为aL,反应达到平衡时容器B的体积为1.5aL,容器B中CH3OH转化率为 ;维持其他条件不变,若打开K一段时间后重新达到平衡,容器B的体积为 L(连通管中气体体积忽略不计,且不考虑温度的影响)。
Ⅲ.如图甲、乙是电化学实验装置。请回答下列问题:
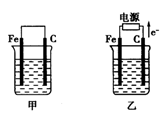
(1)若两池中均盛放CuSO4溶液,甲池中石墨棒上的电极反应式为____________________.
(2)若甲池中盛放饱和NaCl溶液,则甲池中石墨棒上的电极反应式为__________________.
在一密闭容器中发生反应N2+3H2 2NH3。达到平衡后,只改变某一个条件时,反应速率与反应进程的关系如图所示:
2NH3。达到平衡后,只改变某一个条件时,反应速率与反应进程的关系如图所示:
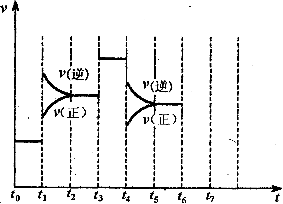
回答下列问题:
(1)t1、t2、t3时刻分别改变的一个条件,t1时刻 t3时刻 t4时刻 。
(2)氨的百分含量最高的时间段是 。
(3)如果在t6对刻,从反应体系中分离出部分氨,t7时刻反应达到平衡状态,请在图中画出反应速率的变化情况;
(4)实验室模拟化工生产,在恒容密闭容器中充入一定量N2和H2后,分别在不同实验条件下反应,N2浓度随时间变化如图1。

在实验Ⅲ中改变条件为采用比实验Ⅰ更高的温度,请在图2中画出实验Ⅰ和实验Ⅲ中NH3浓度随时间变化的示意图。
有可逆反应Fe(s)+CO2(g)  FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K="2.2" 。
FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K="2.2" 。
(1)能判断该反应达到平衡状态的依据是 (双选,填序号)。
A.容器内压强不变了 B.c(CO)不变了 C.v正(CO2)=v逆(CO) D.c(CO2)=c(CO)
(2)该反应的正反应是_____________(选填“吸热”、“放热”)反应。
(3)写出该反应的平衡常数表达式______________。若起始时把Fe和CO2放入体积固定的密闭容器中,CO2的起始浓度为2.0mol/L,某温度时达到平衡,此时容器中CO的浓度为1.0 mol/L,则该温度下上述反应的平衡常数K=______________(保留二位有效数字)。
(4)若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,如果改变下列条件,反应混合气体中CO2的物质的量分数如何变化(选填“增大”、“减小”、“不变”)。
①升高温度________________;②再通入CO_________________。
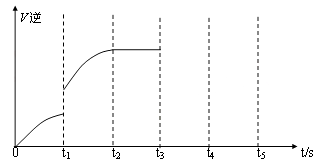
(5)该反应的逆反应速率随时间变化的关系如图:
①从图中看到,反应在t2时达平衡, 在t1时改变了某种条件,改变的条件可能是(填序号)
__ ___。(单选)
A.升温 B.增大CO2浓度
②如果在t3时从混合物中分离出部分CO,t4~ t5时间段反应处于新平衡状态,请在图上画出t3~ t5的V(逆)变化曲线
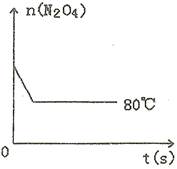
在80℃时,0.40mol的N2O4气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) n(mol) |
0 |
20 |
40 |
60 |
80 |
100 |
| n(N2O4) |
0.40 |
a |
0.20 |
c |
d |
e |
| n(NO2) |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
已知:N2O4 2NO2,△H>0,
2NO2,△H>0,
(1)计算20s~40s内用N2O4表示的平均反应速率为 。
(2)计算在80℃时该反应的平衡常数K= 。
(3)反应进行至100s后将反应混合物的温度降低,混合气体的颜色 (填“变浅”、“变深”或“不变”)。
(4)要增大该反应的K值,可采取的措施有(填序号) ,若要重新达到平衡时,使c(NO2)/c(N2O4)值变小,可采取的措施有(填序号) 。
A、增大N2O4的起始浓度 B、向混合气体中通入NO2
C、使用高效催化剂 D、升高温度
(5)如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60℃时N2O4物质的量的变化曲线。
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,工业上合成氨反应通常用铁触媒作催化剂,反应方程式为:N2+3H2 2NH3 △H<0。
2NH3 △H<0。
(1)已知N2(g)+3H2(g)  2NH3(g) ΔH=-92kJ·mol-1,拆开1mol H-H键,1molN≡N键分别需要的能量是436kJ、、946kJ,则拆开1molN-H键需要的能量是__________。
2NH3(g) ΔH=-92kJ·mol-1,拆开1mol H-H键,1molN≡N键分别需要的能量是436kJ、、946kJ,则拆开1molN-H键需要的能量是__________。
(2)合成氨反应达到平衡后将容器的容积压缩到原来的1/2,其他条件不变,对平衡体系产生的影响是 (填字母序号)。
| A.c(H2)减小 |
| B.正反应速率加快,逆反应速率减慢 |
| C.NH3的物质的量增加 |
| D.平衡常数K增大 |
E.平衡向正方向移动
(3) 如图2所示,在甲、乙两容器中分别充入1molN2和3molH2,使甲、乙两容器初始容积相等。在相同温度下发生反应N2(g)+3H2(g)  2NH3(g) ,并维持反应过程中温度不变。已知甲容器中H2的转化率随时间变化的图像如图3所示,请在图3中画出乙容器中H2的转化率随时间变化的图像。
2NH3(g) ,并维持反应过程中温度不变。已知甲容器中H2的转化率随时间变化的图像如图3所示,请在图3中画出乙容器中H2的转化率随时间变化的图像。


(4)若反应N2(g)+3H2(g)  2NH3(g)在一容积固定不变的容器内进行,并维持反应过程中温度不变。若平衡从正向建立,且起始时N2与H2的物质的量分别为amol、bmol,当a:b=______时,达到平衡后NH3的体积分数最大。
2NH3(g)在一容积固定不变的容器内进行,并维持反应过程中温度不变。若平衡从正向建立,且起始时N2与H2的物质的量分别为amol、bmol,当a:b=______时,达到平衡后NH3的体积分数最大。
一定温度下,在容积固定的VL密闭容器里加入nmolA,2nmolB,发生反应A (g)+2B (g) 2C (g) △H<0,反应达到平衡后测得平衡常数为K,此时A的转化率为x.
2C (g) △H<0,反应达到平衡后测得平衡常数为K,此时A的转化率为x.
(1)K和x的关系满足K=_____________,在保证A浓度不变的情况下,增大容器的体积,平衡______(填字母)。A.向正反应方向移动 B.向逆反应方向移动 C.不移动
(2)若该反应的逆反应速率与时间的关系如图所示:
①可见反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的是什么条件:t2时_____________;t8时_____________;
②t2时平衡向___________(填“正反应”或“逆反应”)方向移动;
③若t4时降压,t5时达到平衡,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系线。
重庆市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2. 5μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:

根据表中数据判断PM2.5待测试样的pH约为____________。
(2)为减少SO2的排放,常采取的措施有:将煤转化为清洁气体燃料。
已知:①2H2(g)+O2(g)═2H2O(g)K1 ②2C(s)+O2(g)═2CO(g)K2
C(s)+H2O(g)=CO(g)+H2(g) K=___________________(用含K1、K2的式子表示)。
(3)汽车尾气净化的主要原理为:2NO(g)+2CO(g) 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。
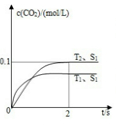
①在T2温度下,0~2s内的平均反应速率υ(N2)= ______________。
②当固体催化剂的质量一定时,增大其表面积可提高化学反应速率.若催化剂的表面积S1>S2,在如图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线。
(4)①已知气缸中生成NO的反应为:N2(g)+O2(g) 2NO(g) △H>0,若1mol空气含0.8molN2和0.2molO2, 1300°C时在密闭容器内反应达到平衡,测得NO为8×10-4mol.计算该温度下的平衡常数K=____________。
2NO(g) △H>0,若1mol空气含0.8molN2和0.2molO2, 1300°C时在密闭容器内反应达到平衡,测得NO为8×10-4mol.计算该温度下的平衡常数K=____________。
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)═2C(s)+O2(g)已知该反应的△H>0,简述该设想能否实现的依据:__________________。
红矾钠(重铬酸钠:Na2Cr2O7•2H2O)是重要的化工原料,工业上用铬铁矿(主要成分是FeO•Cr2O3)制备红矾钠的过程中会发生如下反应:4FeO(s)+Cr2O3(s)+8Na2CO3(s)+7O2(g) 8Na2CrO4(s)+
8Na2CrO4(s)+
2Fe2O3(s)+8CO2(g) ΔH<0
(1)请写出上述反应的化学平衡常数表达式:K= 。
(2)图1、图2表示上述反应在t1时达到平衡,在t2时因改变某个条件而发生变化的曲线。由图1判断,反应进行至t2时,曲线发生变化的原因是____________________(用文字表达);
由图2判断,t2到t3的曲线变化的原因可能是________(填写序号)。
| A.升高温度 | B.加了催化剂 | C.通入O2 | D.缩小容器体积 |

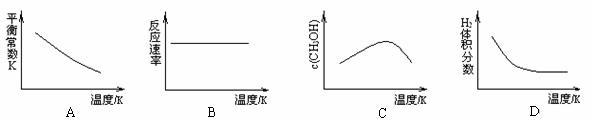
(3) 工业上可用上述反应中的副产物CO2来生产甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g),已知该反应能自发进行,在容积固定的密闭容器中,由CO2和H2合成甲醇,则下列图像正确的是 。
CH3OH(g)+H2O(g),已知该反应能自发进行,在容积固定的密闭容器中,由CO2和H2合成甲醇,则下列图像正确的是 。
工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如下图:
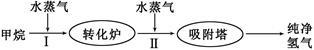
(1)此流程的第II步反应为:CO(g)+H2O(g) H2(g)+CO2(g),该反应的平衡常数随温度的变化如下表:
H2(g)+CO2(g),该反应的平衡常数随温度的变化如下表:
| 温度/℃ |
400 |
500 |
830 |
| 平衡常数K |
10 |
9 |
1 |
从上表可以推断:此反应是 (填“吸”或“放”)热反应。在830℃下,若开始时向恒容密闭容器中充入1mo1CO和2mo1H2O,则达到平衡后CO的转化率为 。
(2)在500℃,按照下表的物质的量(按照CO、H2O、H2、CO2的顺序)投入恒容密闭容器中进行上述第II步反应,达到平衡后下列关系正确的是 。
| 实验编号 |
反应物投入量 |
平衡时H2浓度 |
吸收或放出的热量 |
反应物转化率 |
| A |
1、1、0、0 |
c1 |
Q1 |
α1 |
| B |
0、0、2、2 |
c2 |
Q2 |
α2 |
| C |
2、2、0、0 |
c3 |
Q3 |
α3 |
A.2c1= c2 =c3 B.2Q1=Q2=Q3 C.α1 =α2 =α3 D.α1 +α2 =1
(3)在一个绝热等容容器中,不能判断此流程的第II步反应达到平衡的是 。
①v(CO2)正=v(H2O)逆
②混合气体的密度不变
③混合气体的平均相对分子质量不变 ④各组分的物质的量浓度不再改变
⑤体系的温度不再发生变化
(4)下图表示此流程的第II步反应,在t1时刻达到平衡、在t2时刻因改变某个条件使浓度发生变化的情况:图中t2时刻发生改变的条件是 、 (写出两种)。
若t4时刻通过改变容积的方法将压强增大为原先的两倍,在图中t4和t5区间内画出CO、CO2浓度变化曲线,并标明物质(假设各物质状态均保持不变)。

1913年,德国化学家哈伯实现了合成氨的工业化生产,被称作解救世界粮食危机的化学天才。现将lmolN2和3molH2投入1L的密闭容器,在一定条件下,利用如下反应模拟哈伯合成氨的工业化生产:N2(g)+3H2(g) 2NH3(g) △H<0
2NH3(g) △H<0
当改变某一外界条件(温度或压强)时,NH3的体积分数ψ(NH3)变化趋势如下图所示。

回答下列问题:
(1)已知:①NH3(g)  NH3(g) △H1
NH3(g) △H1
②N2(g)+3H2(g) 2NH3(l) △H2
2NH3(l) △H2
则反应N2(g)+3H2(g) 2NH3(g)的△H= (用含△H1、△H2的代数式表示)。
2NH3(g)的△H= (用含△H1、△H2的代数式表示)。
(2)合成氨的平衡常数表达式为____ ,平衡时,M点NH3的体积分数为10%,则N2的转化率为 (保留两位有效数字)。
(3)X轴上a点的数值比b点 (填“大”或“小”)。上图中, Y轴表示 (填“温度”或“压强”),判断的理由是 。
(4)若将1mol N2和3mol H2分别投入起始容积为1L的密闭容器中,实验条件和平衡时的相关数据如下表所示:
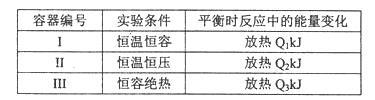
下列判断正确的是____。
| A.放出热量:Ql< Q2< △Hl | B.N2的转化率:I> III |
| C.平衡常数:II >I | D.达平衡时氨气的体积分数:I>II |
(5)常温下,向VmL amoI.L-l的稀硫酸溶液中滴加等体积bmol.L-l的氨水,恰好使混合溶液呈中性,此时溶液中c(NH4+)__c(SO42-)(填“>”、“<”或“=”)。
(6)利用氨气设计一种环保燃料电池,一极通入氨气,另一极通入空气,电解质是掺杂氧化钇(Y203)的氧化锆(ZrO2)晶体,它在熔融状态下能传导O2-。写出负极的电极反应式 。
CO是火力发电厂释放出的主要尾气,为减少对环境污染,发电厂试图采用CO与Cl2在催化剂的作用下合成光气(COCl2)。某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:
CO(g) +Cl2(g)  COCl2(g) ΔH =" a" kJ/mol
COCl2(g) ΔH =" a" kJ/mol
反应过程中测定的部分数据如下表:
| t/min |
n (CO)/mol |
n (Cl2)/mol |
| 0 |
1.20 |
0.60 |
| 1 |
0.90 |
|
| 2 |
0.80 |
|
| 4 |
|
0.20 |
(1)反应0~2min末的平均速率v(COCl2)=______________mol/(L∙min)。
(2)在2min~4min间,v(Cl2)正______________v(Cl2)逆(填“>”、“=”或“<”),该温度下K =_________。
(3)在表格中画出0~4min末n(COCl2)随时间的变化示意图

(4)已知X、L可分别代表温度或压强,下图表示L一定时,CO的转化率随X的变化关系。

X代表的物理量是___________;a_______0 (填“>”,“=”,“<”),依据是___________。
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g) + CO(g) CH3OH(g)
CH3OH(g)
(1)判断反应达到平衡状态的依据是 (填序号)。
a.生成CH3OH的速率与消耗CO的速率相等
b.混合气体的密度不变
c.混合气体的平均相对分子质量不变
d.CH3OH、CO、H2的浓度都不再发生变化
(2)下表所列数据是该反应在不同温度下的化学平衡常数(K)
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
①该反应的平衡常数表达式K= ,△H 0(填“>”、“<”或“=”)。
②要提高CO的转化率,可以采取的措施是_____________(填序号)。
a.升温 b.加入催化剂 c.增加CO的浓度
d.加入H2加压 e.加入惰性气体加压 f.分离出甲醇
(3)右图表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A__________C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A___________C,由状态B到状态A,可采用____________的方法(填“升温”或“降温”)。

(4)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH =-a kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH =-b kJ·mol-1 ③H2O(g)= H2O(l) ΔH=-c kJ·mol-1
写出1摩尔液态CH3OH不完全燃烧生成一氧化碳和液态水的热化学方程式_________________。
某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示。
(1)根据左表中数据,在右图中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:
| t/S |
X/mol |
Y/mol |
Z/mol |
 |
| 0 |
1.00 |
1.00 |
0.00 |
|
| 1 |
0.90 |
0.80 |
0.20 |
|
| 3 |
0.75 |
0.50 |
0.50 |
|
| 5 |
0.65 |
0.30 |
0.70 |
|
| 9 |
0.55 |
0.10 |
0.90 |
|
| 10 |
0.55 |
0.10 |
0.90 |
|
| 14 |
0.55 |
0.10 |
0.90 |
(2)体系中发生反应的化学方程式是______________
(3)列式计算该反应在0-3S时间内产物Z的平均反应速率:_______________
(4)该反应达到平衡时反应物X的转化率等于___________________________
(5)如果该反应是放热反应。改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线①、②、③(如图所示)则曲线①、②、③所对应的实验条件改变分别是:① _______ ②______ ③______。

(1)利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸。
已知:①N2(g)+O2(g)=2NO(g) △H="+180.5" kJ/mol
②N2(g)+3H2(g)  2NH3(g) △H=-92.4 kJ/mol
2NH3(g) △H=-92.4 kJ/mol
③2H2(g)+O2(g) = 2H2O(g) △H=-483.6 kJ/mol
氨催化氧化完全生成一氧化氮气体和水蒸气的热化学方程式为 。
(2)研究在其他条件不变时,改变起始物氢气的物质的量对N2(g)+3H2(g)  2NH3(g)反应的影响实验结果如图所示(图中T表示温度,n表示物质的量):
2NH3(g)反应的影响实验结果如图所示(图中T表示温度,n表示物质的量):

①图像中T2和T1的关系是:T2 T1(填“高于”“低于”“等于”“无法确定”)。
②a、b、c三点中,N2转化率最高的是 (填字母)。
③若容器容积为1L,T2℃在起始体系中加入1 mol N2,n(H2)=3mol,经过5 min反应达到平衡时H2的转化率为60%,则v(NH3)= 。保持容器体积不变,若起始时向容器内放入2 mol N2和6 mol H2,达平衡后放出的热量为Q,则Q___110.88 kJ(填“>”、“<”或“=”)。
试题篮
()