甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
I:CH4(g)+H2O(g)=CO(g) + 3H2(g) △H =+206.0 kJ·mol-1
II:CO(g)+2H2(g)=CH3OH (g) △H=-129.0 kJ·mol-1
(1)CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为 。
(2)将1.0 mol CH4和2.0 mol H2O ( g )通入容积为10 L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如图。

①假设100 ℃时达到平衡所需的时间为5 min,则用H2表示该反应的平均反应速率为 。
②100℃时反应I的平衡常数为 。
(3)在压强为0.1 MPa、温度为300℃条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下发生反应II生成甲醇,平衡后将容器的容积压缩到原来的l/2,其他条件不变,对平衡体系产生的影响是 (填字母序号)。
| A.c ( H2 )减少 |
| B.正反应速率加快,逆反应速率减慢 |
| C.CH3OH 的物质的量增加 |
| D.重新平衡c ( H2 )/ c (CH3OH )减小 E.平衡常数K增大 |
(4)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+ 做氧化剂把水中的甲醇氧化成CO2而净化。实验室用图装置模拟上述过程

①写出阳极电极反应式 。
②请写出除去甲醇的离子方程式 。
H2O2是一种常用绿色氧化剂,在化学研究中应用广泛。
(1)空气阴极法电解制备H2O2的装置如下图所示,主要原理是在碱性电解质溶液中,通过利用空气中氧气在阴极还原得到H2O2和稀碱的混合物。试回答:

①直流电源的a极名称是 。
②阴极电极反应式为 。
③1979年,科学家们用CO、O2和水在三苯膦钯的催化下室温制得了H2O2。相对于电解法,该方法具有的优点是安全、 。
(2)Fe3+对H2O2的分解具有催化作用。利用图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的 (填“深”或“浅”),其原因是 。

(3)用H2O2和H2SO4的混合溶液可溶解印刷电路板金属粉末中的铜。反应的离子方程式是 ,控制其它条件相同,印刷电路板的金属粉末用10%H2O2 和3.0mol·L-1H2SO4溶液处理,测得不同温度下铜的平均溶解速率(见下表)
| 温度(℃) |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
| Cu的平均溶解速率 (×10-3mol·min-1) |
7.34 |
8.01 |
9.25 |
7.98 |
7.24 |
6.73 |
5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度的升高而下降,其主要原因是 。
氨气是重要化工产品之一。传统的工业合成氨技术的反应原理是:
N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ/mol。在500 ℃、20 MPa时,将N2、H2置于一固定容积的密闭容器中反应,反应过程中各种物质的量变化如图所示,回答下列问题:
2NH3(g) ΔH=-92.4 kJ/mol。在500 ℃、20 MPa时,将N2、H2置于一固定容积的密闭容器中反应,反应过程中各种物质的量变化如图所示,回答下列问题:

(1)计算反应在第一次平衡时的平衡常数K= 。(保留二位小数)
(2)由第一次平衡到第二次平衡,平衡移动的方向是 ,采取的措施是 。
(3)45 min时刻改变的条件是 。
(4)产物NH3在5~10 min、25~30min和45~50 min时平均反应速率从大到小的排列次序为 (平均反应速率分别以v1、v2、v3表示)。
(5)随着条件的改变,达到三次平衡时H2的转化率也发生[了变化,如分别以α1、α2、α3表示,其中最小的是 。
(6)请在图中用实线表示25~45、45~60min 两阶段化学平衡常数K的变化图像。

某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定。
(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g)
2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于下表:
| 温度/℃ |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
| 平衡总压强/kPa |
5.7 |
8.3 |
12.0 |
17.1 |
24.0 |
| 平衡气体总浓 度/mol·L-1 |
2.4×10-3 |
3.4×10-3 |
4.8×10-3 |
6.8×10-3 |
9.4×10-3 |
①可以判断该分解反应已经达到平衡的是_______________ 。
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0 ℃时的分解平衡常数:________。
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0 ℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量_________________ (填“增加”,“减少”或“不变”)。
④氨基甲酸铵分解反应的焓变ΔH_______________0(填“>”、“=”或“<”),熵变ΔS________________0(填“>”、“=”或“<”)。
(2)已知:NH2COONH4+2H2O NH4HCO3+NH3·H2O
NH4HCO3+NH3·H2O
该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间的变化趋势如下图所示。
⑤计算25.0 ℃时,0~6 min氨基甲酸铵水解反应的平均速率:________。
⑥根据图中信息,如何说明该水解反应速率随温度升高而增大:______________ _______________________________。
尿素是蛋白质代谢的产物,也是重要的化学肥料。工业合成尿素反应如下:
(1)在一个真空恒容密闭容器中充入CO2和NH3发生上述反应合成尿素,恒定温度下混合气体中的氨气含量如图所示。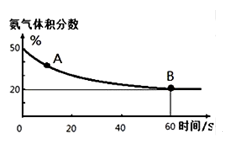
①A点的正反应速率v正(CO2)_______B点的逆反应速率v逆(CO2)(填“>”、“<”或“=”);
氨气的平衡转化率为________________________。
②关于上述反应的平衡状态下列说法正确的是________________
| A.分离出少量的尿素,反应物的转化率将增大 |
| B.平衡时再充入一定量NH3 (g),CO2的转化率增大 |
| C.NH3的转化率始终等于CO2的转化率 |
| D.加入有效的催化剂能够提高尿素的产率 |
(2)合成尿素的反应在进行时分为如下两步:
第一步:2NH3(l)+CO2(g) H2NCOONH4(l) (氨基甲酸铵) △H1
H2NCOONH4(l) (氨基甲酸铵) △H1
第二步:H2NCOONH4(l) H2O(l)+H2NCONH2(l) △H2
H2O(l)+H2NCONH2(l) △H2
某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如下图Ⅰ所示: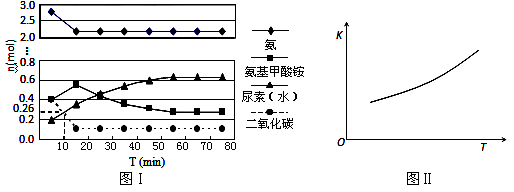
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第_______步反应决定,总反应进行到 _______ min时到达平衡。
②反应进行到10 min时测得CO2的物质的量如图所示,则用CO2表示的第一步反应的速率v(CO2)=_________ 。
③第二步反应的平衡常数K随温度的变化如上右图Ⅱ所示,则△H2 ________0(填“>”“<”或“=”)
④第一步反应的△S ________0(填“>”、“<”或,“=”),在________(填“较高”或“较低”)温度下有利于该反应自发进行。
(3)氨基甲酸铵极易水解成碳酸铵,酸性条件水解更彻底。将氨基甲酸铵粉末逐渐加入1L0.1mol/L的盐酸溶液中直到pH=7(室温下,忽略溶液体积变化),共用去0.052mol氨基甲酸铵,此时溶液中几乎不含碳元素。此时溶液中c(NH4+)= _____________________;NH4+水解平衡常数值为______________。
炼油厂常将裂解产生的其它烯烃加氢,对产物再次裂解以提高乙烯产量。相关加成反应如下:
① (g)+H2(g)
(g)+H2(g)  CH3CH2CH2CH3(g) △H1
CH3CH2CH2CH3(g) △H1
② (g)+H2(g)
(g)+H2(g)  CH3CH2CH2CH3(g) △H2
CH3CH2CH2CH3(g) △H2
(1)已知反应①、反应②平衡常数K1、K2如下,下列叙述正确的是____;
| 温度(℃) |
300 |
320 |
340 |
| K1 |
4.8×10-4 |
2.5×10-4 |
1.3×10-4 |
| K2 |
8.4×105 |
3.5×103 |
1.6×103 |
A.△H1>0;△H2<0
B.反应①、反应②都是丙烯加氢,所以△H1=△H2
C.相同条件下反应②的转化率大于反应①的转化率
D.从平衡常数推测,相同条件下反应②的反应速率很大,反应①的反应速率很小
(2)2-丁烯的顺、反异构转换过程的△H=_______(用△H1、△H2表示)
 (g)
(g) 
 (g) △H
(g) △H
(3)在一定温度下,将等物质的量的反式2-丁烯和H2充入2L密闭容器中,发生反应②,容器内各物质浓度如图所示:

①前10分钟,平均反应速率v(H2)为______mol·L-1·min-1
②该温度下,此反应平衡常数K=_______(平衡常数不用写单位)
(4)已知表示H2和CH3CH2CH3标准燃烧热的热化学方程式为:
①H2(g)+ O2(g)
O2(g) H2O(l) △H=-285.8kJ•mol-1
H2O(l) △H=-285.8kJ•mol-1
②CH3CH2CH3(g)+5O2(g) 3CO2(g)+4H2O(l) △H=-2215kJ•mol-1
3CO2(g)+4H2O(l) △H=-2215kJ•mol-1
丁烯加成反应的热化学方程式为:
③CH3CH=CH2(g)+H2(g) CH3CH2CH3(g) △H=-125.4kJ•mol-1
CH3CH2CH3(g) △H=-125.4kJ•mol-1
则表示CH3CH=CH2标准燃烧热的热化学方程式为__________________。
氯气用途广泛,但在使用时,一般会产生氯化氢。工业上可用O2将HCl转化为Cl2,以提高效益,减少污染。反应为:
完成下列填空:
(1).该反应化学平衡常数K的表达式为 ;
实验测得P0压强下,HCl平衡转化率α(HCl)随反应温度T的变化如图所示,则正反应是 反应(填“吸热”或者“放热”)。
(2).上述实验中若压缩体积使压强由P0增大至P1,在图中画出P1压强下HCl平衡转化率α(HCl)随反应温度T变化的曲线,并简要说明理由: 。
(3).该反应在P0、320°C条件下进行,达平衡状态A时,测得容器内n(Cl2)=7.2×10–3mol,则此时容器中的n(HCl)= mol。
(4).对该反应达到平衡后,以下分析正确的是 (选填编号)。
a.增加n(HCl),对正反应的反应速率影响更大
b.体积不变加入稀有气体,对正反应的反应速率影响更大
c.压强不变加入稀有气体,对逆反应的反应速率影响更大
d.如果平衡常数K值增大,对逆反应的速率影响更大
(5).氯元素能形成多种离子。在水溶液中1molCl–、1mol ClOx–(x=1,2,3,4)能量的相对大小如图所示,写出B→A+C反应的热化学方程式(用离子符号表示) ;若有1.5molB发生反应,转移电子 mol。

苯硫酚(PhSH)是一种用途广泛的有机合成中间体。工业上用常用氯苯(PhCl)和硫化氢(H2S)在高温下反应来制备苯硫酚,但会有副产物苯(PhH)生成。
I: PhCl(g)+H2S(g) PhSH(g)+HCl(g) △H1=—16.8kJ·mol-1
PhSH(g)+HCl(g) △H1=—16.8kJ·mol-1
II: PhCl(g)+H2S(g) ==PhH(g)+ HCl(g)+ S8(g) △H2
S8(g) △H2
回答下列问题:
(1)反应I为可逆反应,写出平衡常数的表达式K=_______________________,
反应II为不可逆反应,△H2=___________0。(填写“>”,“<”,“=”)

(2)上述两个反应的能量变化如图一所示,则在某温度时反应速度v(I)__________v(II)(填写“>”,“<”,“=”)
(3)现将一定量的氯苯和硫化氢置于一固定容积的容器中模拟工业生产过程,在不同温度下均反应20分钟测定生成物的浓度,得到图二和图三。
①请解释图二中两条曲线的变化_______________________。
②若要提高主产物苯硫酚的产量,可采取的措施是______________________。
(4)请根据图二、图三,画出恒温恒容条件下反应主产物苯硫酚的物质的量随时间变化的曲线图。

研究氮的氧化物、硫的氧化物、碳的氧化物等大气污染物的处理具有重要意义。
(1)汽车排气管内安装的催化转化器,可使尾气中主要污染物转化为无毒物质。下列说法能说明恒温恒容条件下的反应;2NO(g)+2CO(g)=N2(g)+2CO2(g)△H="-746.5" kJ·mol-1已达到化学平衡的是 。
A.单位时间内消耗了2moINO的同时消耗的2moICO
B.CO与CO2的物质的量浓度相等的状态
C.气体密度保持不变的状态
D.气体平均摩尔质量保持不变的状态
(2)NO2与SO2混合可发生反应:NO2(g)+SO2(g) SO3(g)+NO(g)。
SO3(g)+NO(g)。
将一定量的NO2与SO2置于绝热恒容密闭容器中发生上述反应,正反应速率随时间变化的趋势如图所示。由图(纵轴代表正反应速率)可知下列说法正确的是 (填字母)。

A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.反应物的总能量高于生成物的总能量
D.△t1=△t2时,SO2的消耗量:a~b段大于b~c段
(3)CO在实际中有以下应用:用Li2CO3和Na2CO3熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气作为正极助燃气,制得在650℃下工作的燃料电池。完成有关的电极反应式。
负极反应式:2CO+2CO32-一4e-=4CO2 正极反应式: 。
(4)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解50 mL 2 mol·L-1的氯化铜溶液的装置示意图:

请回答:①甲烷燃料电池的负极反应式是 。
②当A中消耗0.15 mol氧气时,B中 极(填”a”或”b”)增重__ __g。
氨气是重要化工产品之一。传统的工业合成氨技术的反应原理是:N2(g)+3H2(g) NH3(g)ΔH=-92.4 kJ/mol。在500 ℃、20 MPa时,将N2、H2置于一个固定容积的密闭容器中发生反应,反应过程中各种物质的量变化如图所示,回答下列问题:
NH3(g)ΔH=-92.4 kJ/mol。在500 ℃、20 MPa时,将N2、H2置于一个固定容积的密闭容器中发生反应,反应过程中各种物质的量变化如图所示,回答下列问题:

(1)计算反应在第一次平衡时的平衡常数K= 。(保留二位小数)
(2)产物NH3在5~10 min、25~30min和45~50 min时平均反应速率(平均反应速率分别以v1、v2、v3表示)从大到小排列次序为 。
(3)H2在三次平衡阶段的平衡转化率分别以α1、α2、α3表示,其中最小的是 。
(4)由第一次平衡到第二次平衡,平衡移动的方向是_______,采取的措施是________。
(5)请在下图中用实线表示25~60min 各阶段化学平衡常数K的变化图像。

化学反应原理在合成氨工业及氨的性质研究中具有广泛的应用。
(1)工业生产硝酸的第一步反应是氨的催化氧化反应,已知下列3 个热化学方程式(K 为平衡常数):

(2)工业合成氨所用的氢气主要来自天然气与水的反应,但这种原料气中往往混有一氧化碳杂质,工业生产中通过如下反应来除去原料气中的CO:CO(g)+H2O(g)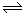 CO2(g)+ H2(g)ΔH<0。
CO2(g)+ H2(g)ΔH<0。
①一定条件下,反应达到平衡后,欲提高CO 的转化率,可采取的措施有 、 。
②在容积为2 L 的密闭容器中发生上述反应,其中c(CO)随反应时间(t)的变化如图甲中曲线Ⅰ,如果在t0时刻将容器容积扩大至4 L,请在图甲中画出t0时刻后c(CO)随反应时间(t)的变化曲线。
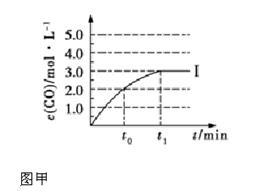
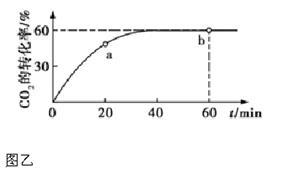
(3)氨气的重要用途是合成尿素,一定条件下,NH3和CO2 合成尿素的反应为 。当加料比例n(NH3)/n(CO2)="4" 时,CO2的转化率随反应时间(t)的变化如图乙所示,a 点v 逆(CO2) b 点v 正(CO2)(填“>”、“<”或“=”),NH3的平衡转化率为 。
。当加料比例n(NH3)/n(CO2)="4" 时,CO2的转化率随反应时间(t)的变化如图乙所示,a 点v 逆(CO2) b 点v 正(CO2)(填“>”、“<”或“=”),NH3的平衡转化率为 。
(4)硫酸工业生产过程中产生的尾气可用氨水吸收,生成的(NH4)2SO3再与硫酸反应,将生成的SO2返回车间作生产硫酸的原料,而生成的(NH4)2SO4可作肥料。常温下,0.1mol·L-1(NH4)2SO4溶液中各离子浓度由大到小的顺序是 ;
若某工厂中使用的是室温下0.1 mol·L-1的氨水,那么该氨水的pH= 。
(已知
工业上可利用“甲烷蒸气转化法生产氢气”,反应为:
CH4(g)+H2O(g)  CO(g)+3H2(g)
CO(g)+3H2(g)
已知温度、压强和水碳比[n(H2O)/n(CH4)]对甲烷平衡含量(%)的影响如下图1:

图1 (水碳比为3) 图2 (800℃)
(1)CH4(g)+H2O(g)  CO(g)+3H2(g)。的
CO(g)+3H2(g)。的 H 0(填“>”或“<”);若在恒温、恒压时,向该平衡体系中通入氦气平衡将 移动(填“向正应方向”、“向逆反应方向”或“不”)。
H 0(填“>”或“<”);若在恒温、恒压时,向该平衡体系中通入氦气平衡将 移动(填“向正应方向”、“向逆反应方向”或“不”)。
(2)温度对该反应的反应速率和平衡移动的影响是 。
(3)其他条件不变,请在图2中画出压强为2MPa时,甲烷平衡含量(%)与水碳比之间关系曲线。(只要求画出大致的变化曲线)
(4)已知:在700℃,1MPa时,1mol CH4与1mol H2O在2L的密闭容器中反应,6分钟达到平衡,此时CH4的转化率为80%,求这6分钟H2的平均反应速率和该温度下反应的平衡常数是多少?(写出计算过程,结果保留小数点后一位数字。)
将1.2mol的A气体充入2L恒容密闭容器中发生反应:A(g)  2B(g)。在三种不同条件下进行实验,A的物质的量随时间的变化如图所示。试回答下列问题:
2B(g)。在三种不同条件下进行实验,A的物质的量随时间的变化如图所示。试回答下列问题:

(1)实验1中,4s时A的转化率为 ;此条件下该反应的平衡常数K1的值为 。
(2)实验2与实验1对比,其可能隐含的反应条件是 。
(3)根据实验3与实验1的图象比较,可推测该反应是 (填“放热”或“吸热”)反应。设实验1~3的平衡常数的值分别为K1、K2、K3,则它们之间的关系为K1 K2 K3(填“>”、“<”或“=”)。
(4)为了验证增大催化剂的表面积、增大压强可提高化学反应速率这一结论,某同学在实验1的基础上又利用该容器设计了实验4和实验5,部分实验条件及数据见下表。请将表格补充完整。
| 实验编号 及其目的 |
V(容积)/L |
t/℃ |
n(A起始)/mol |
n(B起始)/mol |
催化剂的质量/g |
催化剂的表面积/m2·g—1 |
| 实验1参照对比实验 |
2 |
80 |
1.2 |
0 |
a |
b |
| 实验4:催化剂的表面积对反应速率的影响 |
|
|
|
|
|
|
| 实验5目的: |
1 |
|
|
|
|
|
甲醇是重要的化工原料,在工业生产上的应用十分广泛。
(1)利用太阳能或生物质能分解水制H2,然后可将H2与CO2转化为甲醇。
已知:光催化制氢:2H2O(l)==2H2(g)+O2(g) ΔH=+571.5 kJ/mol
H2与CO2耦合反应:3H2(g)+CO2(g)==CH3OH(l)+H2O(l) ΔH=-137.8 kJ/mol
则反应:2H2O(l)+CO2(g) ="=" CH3OH(l)+3/2O2(g)的ΔH= kJ/mol
你认为该方法需要解决的技术问题有 。
a. 开发高效光催化剂
b. 将光催化制取的H2从反应体系中有效分离,并与CO2耦合催化转化
c. 二氧化碳及水资源的来源供应
(2)工业上由甲醇制取甲醛的两种方法如下(有关数据均为在298 K时测定):
反应I:CH3OH(g)=HCHO(g)+H2(g) ΔH1=+92.09kJ/mol,K1=3.92×10-11。
反应II:CH3OH(g)+1/2O2(g)=HCHO(g)+H2O(g) ΔH2=-149.73 kJ/mol,K2=4.35×1029。
①从原子利用率看,反应(填“I”或“II”。下同)制甲醛的原子利用率更高 。从反应的焓变和平衡常数K值看,反应 制甲醛更有利。(原子利用率表示目标产物的质量与生成物总质量之比。)
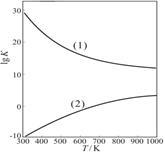
②右图是甲醇制甲醛有关反应的lgK(平衡常数的对数值)随温度T的变化。图中曲线(1)表示 (填“I”或“II”)的反应 。
(3)污水中的含氮化合物,通常先用生物膜脱氮工艺进行处理,在硝化细菌的作用下将NH4+氧化为
NO3-(2NH4++3O2=2HNO2+2H2O +2H+;2HNO2 +O2=2HNO3)。然后加入甲醇,甲醇和NO3-反应转化为两种无毒气体。
①上述方法中,1 g铵态氮元素转化为硝态氮元素时需氧的质量为 g。
②写出加入甲醇后反应的离子方程式:
(4)某溶液中发生反应:A 2B+C,A的反应速率v(A)与时间t的图象如图所示。若溶液的体积为2L,且起始时只加入A物质,下列说法错误的是
2B+C,A的反应速率v(A)与时间t的图象如图所示。若溶液的体积为2L,且起始时只加入A物质,下列说法错误的是

A.图中阴影部分的面积表示0~2min内A的物质的量浓度的减小值
B.反应开始的前2min,A的平均反应速率小于0.375mol・L-1・min-1
C.至2min时,A的物质的量减小值介于0.5mol至1mol之间
D.至2min时,B的物质的量浓度c(B)介于1~1.5mol・L-1之间
在一密闭容器中发生反应N2+3H2 2NH3,△H<0达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:回答下列问题:
2NH3,△H<0达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:回答下列问题:
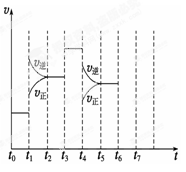
(1)处于平衡状态的时间段是 (填选项)。
A.t0~t1
B.t1~t2
C.t2~t3
D.t3~t4
E.t4~t5
F.t5~t6
(2)t1、t3、t4时刻分别改变的一个条件是_____(填选项)。
A.增大压强
B.减小压强
C.升高温度
D.降低温度
E.加催化剂
F.充入氮气
t1时刻 ;t3时刻 ;t4时刻 。
(3)依据(2)中的结论,下列时间段中,氨的百分含量最高的是 (填选项)。
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
(4)如果在t6时刻,从反应体系中分离出部分氨,t7时刻反应达到平衡状态,请在图中画出反应速率的变化曲线。
(5)一定条件下,合成氨反应达到平衡时,测得混合气体中氨气的体积分数为20%,则反应后与反应前的混合气体体积之比为 。
试题篮
()